Indice
La teoria del legame di valenza spiga in modo efficace il modo con cui è possibile formare un legame tra due o più elementi, e della forma che la molecola assume nello spazio tridimensionle. La teoria del legame di valenza non spiega, però, le proprietà che alcune molecole possiedono come, ad esempio, il paramagnetismo. Per paramagnetismo si intende la tendenza che una molecola ha ad avvicinarsi ad un campo magnetico. Alcune molecole che presentano paramagnetismo sono: l’ossigeno, e l’azoto
Mediante il legame di valenza, in generale, è possibile illustrare la disposizione degli elettroni attorno al nucleo di un elemento ma la disposizione degli elettroni all’interno di un orbitale molecolare, comune a due elementi, può essere spiegata con la teoria degli orbitali molecolari che, per alcune somiglianze, può essere definita come una diretta continuazione della teoria del legame di valenza.
Secondo la teoria degli orbitali molecolari in una molecola si presentano degli orbitali leganti e degli orbitali antileganti in un numero che varia a seconda degli elementi coinvolti nella molecola.
Orbitali leganti.
L’orbitale legante è a minor energia e per questo motivo si forma prima. Gli elettroni nell’orbitale legante sono presenti in una zona comune ai due nuclei o, in altri termini, la densità di probabilità di trovare l’elettrone in una zona comune ai due nuclei è elevata.
Orbitale antileganti.
L’orbitale antileganti ha una maggiore energia e per questo motivo, in sequenza, è il secondo a formarsi. L’orbitale antilegante e caratterizzato dalla presenza di elettroni distanti da ambedue gli atomi.
L’ordine di legame.
L’ordine di legame è un numero pari a zero o positivo risultante dal rapporto degli elettroni dell’orbitale legante e dal numero degli elettroni risultanti dall’orbitale antilegante. La sua formula è la
Visto che il numero di elettroni antileganti (a maggior energia) è, secondo la teoria, minore uguale al numero di elettroni leganti il valore può essere soltanto positivo o pari a zero. In quest’ultimo caso il numero di elettroni leganti è uguale al numero di elettroni antileganti.
Il paramagnetismo secondo la teoria degli orbitali molecolari.
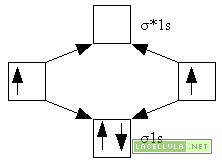
Prendiamo a titolo di esempio l’orbitale molecolare dell’idrogeno. La sua configurazione elettronica molecolare fa in modo che ci sia un doppietto nell’orbitale legante 1σs. Pertanto vi è una parità tra elettroni con spin opposti. Se manca la parità tra elettroni con spin opposto la molecola è paramagnetica, poichè l’elettrone che orbita attorno al nucleo crea un campo magnetico che influenza l’intera molecola in caso di avvicinamento a magneti.
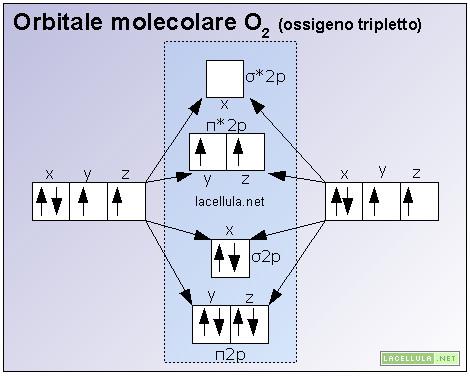
Orbitali molecolari dell’ossigeno e spiegazione del suo paramagnetismo
I due elettroni singoletti producono un campo magnetico e, per questo motivo, la molecola dell’ossigeno (O2) può essere influenzata da campi magnetici rendendosi paramagnetica. Il paramagnetismo è la peculirità che non tutte le molecole possiedono di essere attratte da campi magnetici.
Orbitale molecolare dell’idrogeno
 σ1s riempendolo. Visto che non ci sono altri elettroni l’orbitale molecolare antilegante non viene riempito.
σ1s riempendolo. Visto che non ci sono altri elettroni l’orbitale molecolare antilegante non viene riempito.