Indice
L’ibridizzazione è un fenomeno per il quale alcuni atomi, acquistando energia, promuovono alcuni loro elettroni verso un orbitale superiore ibridizzando l’orbitale. A seconda del tipo di orbitale coinvolto si osservano diversi tipi di ibridizzazione. Le ibridizzazioni più comuni sono quelle sp, sp2, sp3, sp3d,sp3d2
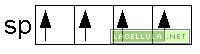
L’ibridizzazione sp
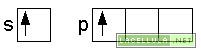
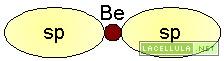
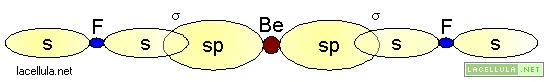
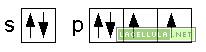
Nell’ibridizzazione sp vengono coinvolti gli orbitale del secondo livello energetico: 2s e 2p. Un elettrone del doppietto in 2s passa a 2p e, nell’ibridizzazione, tale orbitale viene unito al 2s. Il caso del fluoruro di berillio (BeF2) può essere un valido esempio perchè in tale molecola lo stato fondamentale del berillio è il seguente
se l’atomo riceve energia dall’esterno lo stato eccitato è il seguente
gli orbitali s e p, successivamente si ibridizzano
L’atomo di berillio, ibridato, in accordo alla teoria del legame di valenza (vb) ha due orbitali ibridi sp, degeneri:
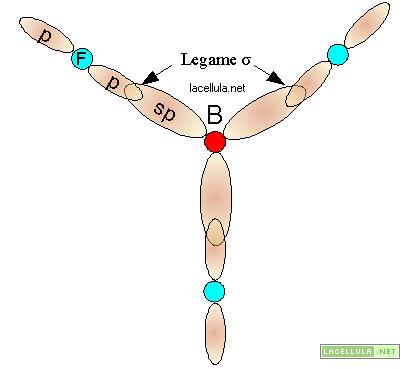
Ibridizzazione sp2
Nell’ibridizzazione sp2 si vengono a formare tre singoletti elettronici che, pertanto, possono legare tre atomi. Il floruro di boro è un ottimo esempio di ibridizzazione sp2. Allo stadio normale il boro, nella molecola di floruro di boro, ha configurazione 1s2,2s2,2p1
Ibridizzazione degli orbitali sp3
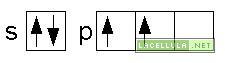
L’ibridizzazione degli orbitali sp3 determina la creazione di quattro orbitali degeneri ed è verificabile negli atomi di metano (CH4) e ammoniaca (NH3). Nel caso dell’ammoniaca si forma una molecola non planare ma prospettica.L’azoto, nella molecola di ammoniaca, ha configurazione elettronica 1S2 2S2 2P3. Pertanto tre elettroni nell’orbitale degenero 2P sono singoletti
La promozione di un elettrone dal doppietto s non avviene e pertanto, direttamente, si verifica l’ibridizzazione dell’orbitale.
L’orbitale ibridido sp ha quattro sotto-orbitali degeneri ma uno è occupato dal doppietto pertanto soltanto tre legami possono essere formati. Il doppietto elettronico influenza la struttura tridimensionale dell’ammoniaca in quanto si pone “sopra” l’atomo di azoto e influenza i legami con l’idrogeno che risultano essere angolati di, circa, 107.3 gradi.
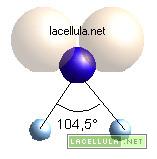
La forma particolare che la molecola dell’acqua possiede può essere spiegata mediante la teoria dell’ibridizzazione sp3. La configurazione elettronica dell’ossigeno allo stadio fondamentale è 1S2 2S2 2P4 :
visto che l’orbitale p è semicompleto l’elettrone singoletto in s non viene promosso e si passa direttamente all’ibridizzazione sp3:
L’orbitale ibrido sp dell’ossigeno contiene due singoletti e due doppietti elettronici. I doppietti si dispongono in modo tale da interagire con i singoletti, allontanandoli. La molecola dell’acqua in virtù di tale repulsione assume la sua tipica forma non lineare:
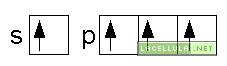
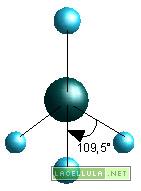
La configurazione del metano (CH4) può essere spiegata tenendo conto dell’ibridizzazione del carbonio. Tale elemento, allo stadio stazionario, ha configurazione 1s2 2s2 2p2
un elettrone dal doppietto 2s viene promosso all’orbitale 2p
e successivamente avviene l’ibridizzazione.
La presenza di quattro singoletti fa si che il carbonio possa formare quattro legami. Nella molecola del metano, in particolare, gli atomi di idrogeno si dispongono tridimensionalmente con un atomo di idrogeno al vertice di una piramide alla cui base vi sono i rimanenti tre atomi di idrogeno