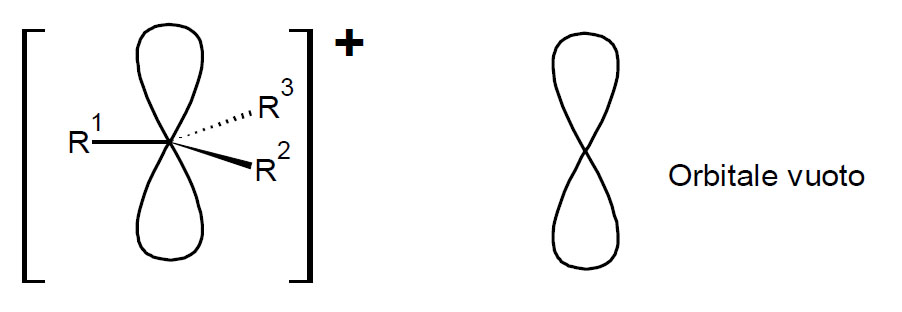Indice
In questa guida spieghiamo cosa sono sostituzioni e addizioni nelle relazioni chimiche organiche.
SOSTITUZIONI
Una sostituzione è una reazione nella quale un atomo o gruppo di atomi (cioè un gruppo funzionale) legato al carbonio con un legame σ viene sostituito da un altro atomo o gruppo funzionale in modo tale che lo scheletro della molecola rimanga invariato dopo la reazione. Una tale definizione si attaglia ad una reattività molto ampia, tanto da necessitare di una ulteriore suddivisione in sottocategorie. Si tratta probabilmente della categoria più grande in assoluto delle reazioni su substrati organici. Possiamo di nuovo distinguere tenendo in considerazione il substrato: saturo, insaturo, aromatico. Quindi possiamo suddividere ancora per tipo di reattivo: nucleofilo, elettrofilo, radicalico, per citare solo i tre più comuni.
SOSTITUZIONI AL CARBONIO SATURO
Sostituzioni Nucleofile
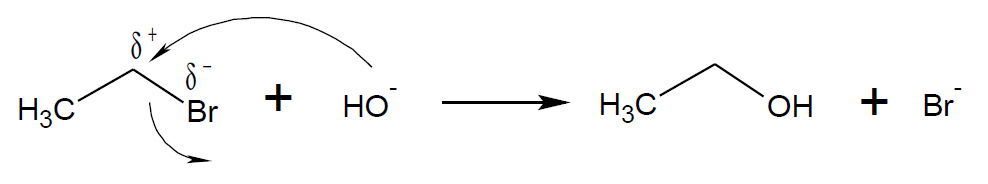
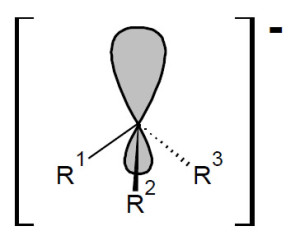
Il nucleofilo (negativo: Nu–) attacca il sito di reazione dalla parte del carbonio, che è polarizzata positivamente, ed il gruppo uscente, in questo caso Br–, viene espulso. La molecola prodotto è neutra ed il gruppo uscente si assume la carica negativa. Il meccanismo della sostituzione nucleofila può oscillare tra i due casi limite SN1 (a due stadi) ed SN2 (monostadio), nel primo caso il gruppo uscente si stacca prima dell’entrata del nucleofilo, dando luogo ad un intermedio carbocationico(4).
nel secondo caso entrata del Nu- ed uscita del gruppo uscente X– avvengono contemporaneamente.
Questo comportamento, dipende da più fattori tra cui la struttura del substrato risulta essere uno dei più importanti. Infatti un substrato con gruppo uscente primario darà più facilmente la sostituzione di tipo SN2 mentre un terziario la SN1, per motivi di ingombro sterico. Il secondario, caso più difficile, potrà dare entrambi i meccanismi in competizione, dei quali uno potrebbe risultare il più favorito in certe condizioni di reazione piuttosto che in altre (solvente, temperatura, gruppo uscente utilizzato ecc. possono modulare la reattività in un senso o nell’altro). In qualche caso si può avere anche una competizione tra reazione di Sostituzione e di Eliminazione (E).
Sostituzioni Elettrofile
Nella sostituzione elettrofila alifatica SE l’interazione substrato-reattivo è analoga alla precedente ma ribaltata sul piano elettronico: il sito di reazione è questa volta polarizzato inversamente (unpolung), sul carbonio si trova una parziale carica negativa che interagisce con un elettrofilo (E+), il gruppo uscente è qui un catione metallico. Molti studi(6) sono stati effettuati in tempi abbastanza recenti sulla struttura dei composti organometallici e sugli intermedi carbanionici
Il carbanione è da considerare una struttura limite dato che anche per il legami più polarizzati, con i metalli più elettropositivi come Na e K, viene data una percentuale di ionicità del legame C-M che non raggiunge mai il 100%. Tuttavia per i composti in cui il legame si presenta fortemente polarizzato si parla comunemente di carbanione. Anche per queste reazioni si può considerare che il meccanismo oscilli tra due meccanismi limite: SE1, a stadi, ed SE2, concertato (monostadio).
Sostituzioni Radicaliche
I primi radicali al carbonio furono scoperti da Gömberg nel 1900; naturalmente si trattava di radicali stabili nel tempo in quanto, allora, non c’erano mezzi adeguati per poter studiare specie labili altamente reattive, quali i semplici radicali al carbonio non stabilizzati. Un tempo una reazione radicalica veniva quasi sempre considerata sinonimo di reazione incontrollabile e solo poche applicazioni ne erano state fatte a livello industriale. Una di queste è la reazione di alogenazione degli alcani, molto utile in quanto i composti alifatici, poco reattivi, non erano facilmente funzionalizzabili in altro modo. Tuttavia se non è condotta in condizioni molto controllate la reazione porta a miscele di composti mono- e poli-alogenati. La reattività varia, a seconda dell’alogeno impiegato, in ordine crescente Br<Cl<F: le bromurazioni sono quindi molto più controllabili delle fluorurazioni. Oggigiorno le reazioni radicaliche sono molto studiate ed utilizzate più frequentemente in modo selettivo anche per le sintesi di complesse strutture di composti di origine naturale, anzi spesso con migliori risultati per le condizioni di reazione più “mild”, cioè con temperature, pressioni, reattivi che non distruggono altre parti della molecola mentre la reazione avviene su un particolare sito.
SOSTITUZIONI AL CARBONIO AROMATICO
Sostituzione Elettrofila SEAr
Es: X= H, Y= NO2+: Nitrazione del benzene
Il substrato benzenico è ricco di elettroni e dà abbastanza facilmente la reazione di sostituzione elettrofila aromatica SEAr (esempi più classici: nitrazione e solfonazione), in condizioni opportune di temperatura e con l’uso di catalizzatori (acidi minerali o acidi di Lewis) che attivino l’anello, molto stabile per via dell’aromaticità . Durante la reazione di sostituzione, infatti, viene temporaneamente persa l’aromaticità, che si recupera alla fine con l’espulsione del gruppo uscente.
Invece, è necessaria la presenza uno o più sostituenti attivanti (EWG o elettron-attrattori) per poter avere la analoga reazione nucleofila.
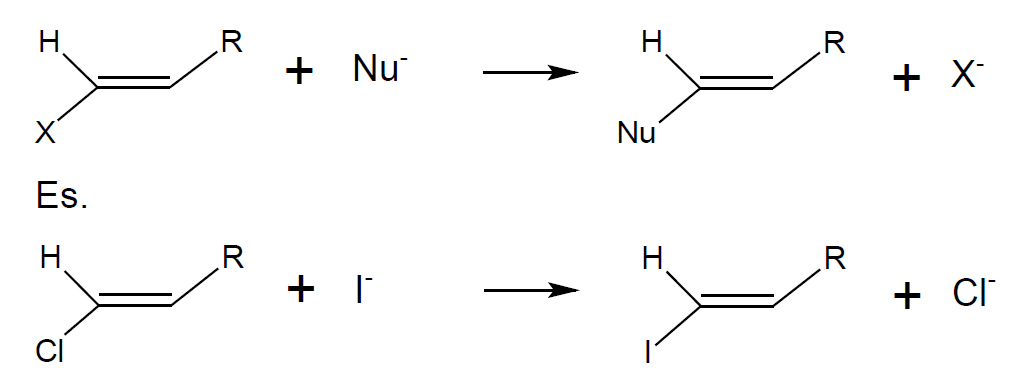
Sostituzione Nucleofila SNAr
Y- = Nucleofilo, X– = gruppo uscente.
Z è un sostituente fortemente elettronattrattore, ciò permette all’anello aromatico, impoverito di elettroni di reagire con un nucleofilo.
Es. Y= Cl, Z= NO2, X= OH–: Idrossi dealogenazione di nitro alogeno benzene.
Sono note anche sostituzioni al carbonio insaturo non aromatico (vinilico), anche se il legame σ di un carbonio sp2 è meno reattivo alla reazione di sostituzione, probabilmente a causa di una certa percentuale di doppio legame su di esso.
ADDIZIONI
Nelle reazioni di addizione (o somma) al substrato si somma il reattivo, quindi da due reagenti otteniamo soltanto un prodotto (a meno di reazioni collaterali ovviamente!). In questo tipo di reazioni è necessario almeno un legame π più debole, dalla sua rottura si originano due nuovi legami σ (forti) che legano due distinte parti del reattivo usato. Appare evidente che i composti saturi non possono dare tali reazioni. Esiste comunque una eccezione: i cicli di piccole dimensioni (3 e 4 atomi) in cui la tensione d’anello elevata rende più deboli e reattivi i legami σ ntraanulari assimilandoli a legami di tipo π.
Anche nel caso delle addizioni possiamo fare più categorie in base ai substrati ed ai reattivi utilizzati. Addizioni: elettrofile, nucleofile, radicaliche. Substrati: doppi e tripli legami CC, doppi legami CO, ecc., per non voler dare che pochi esempi.
ADDIZIONI AL DOPPIO LEGAME C=C
Addizioni elettrofile
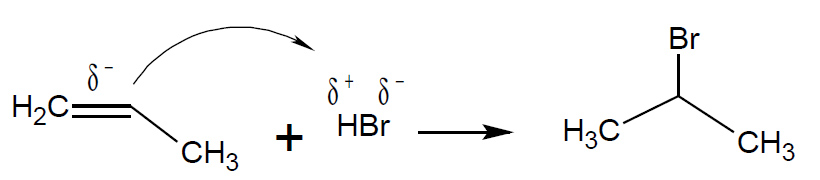
Si possono avere reazioni di addizione al doppio legame da parte di molti elettrofili, sono reazioni ampiamente sfruttate anche per la regioselettività di addizione: la regola di Markownikoff dirige l’atomo di idrogeno (elettrofilo) sul carbonio terminale, mentre il nucleofilo si lega conseguentemente nella posizione più interna, dove si è formato il carbocatione più ramificato e quindi più stabile. Se il doppio legame non è terminale l’esito può essere più incerto.
Tuttavia utilizzando reattivi meno convenzionali e più ingombranti, come i composti del boro, sono state raggiunti ottimi livelli di selettività anche in alcheni non terminali.
addizione elettrofila di acido alogenidrico ad alchene
Addizioni nucleofile
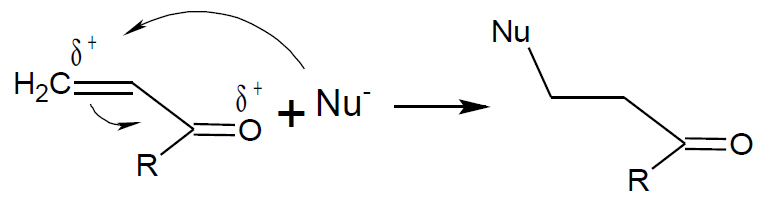
Dato che il doppio legame è generalmente ricco di elettroni le addizioni nucleofile al doppio legame avvengono solo quando esso è attivato dalla presenza di un gruppo elettronattrattore come un carbonile, un estere, un nitrile ecc. Tuttavia questa categoria di reazioni è molto importante: le addizioni ai composti carbonilici α,β-insaturi da parte di reattivi organometallici ne costituisce un capitolo molto ampio e sfruttato.
addizione nucleofila su composto carbonilico alfa, beta insaturo
Addizioni radicaliche
Reazioni sempre più utilizzate grazie agli studi di Giese, Curran, Zard, e altri. I radicali possono risultare, inaspettatamente, molto selettivi in reazioni su substrati anche molto complessi, senza bisogno di gruppi protettori su funzioni molto delicate e sensibili a molti reagenti polari.
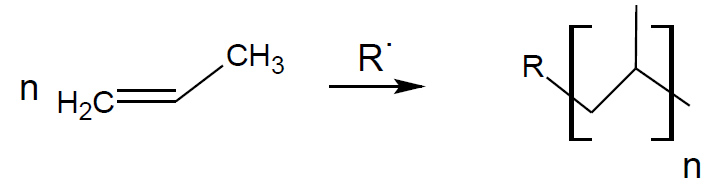
Poliaddizioni
La reazione di poliaddizione radicalica è la principale via di ottenimento di prodotti industriali di tipo polimerico: materiali plastici, elastomeri ecc. con cui vengono prodotti di largo consumo quali: contenitori alimenti, bottiglie, gomme, vernici ecc. Si riporta qualche esempio in figura.
poliaddizione radicalica
ADDIZIONI AL TRIPLO LEGAME CC
Simili alle precedenti anche se meno utilizzate, quando si usano reattivi convenzionali possono portare a prodotti di somma singola o doppia e a miscele delle due.
Tuttavia più recentemente sono stati impiegati reattivi di tipo diverso portando talvolta a risultati sorprendenti:
Legami C-M e legami X-H (X = Si, Sn, Se ecc) si possono addizionare a tripli legami formando doppi legami di sterochimica definita e riproducibile.
ADDIZIONI AL DOPPIO LEGAME C=O
Data la polarità del legame carbonio–ossigeno (C+-O-) dovuta alla forte differenza di elettronegatività parliamo soltanto di
Addizione nucleofila
La modalità con cui essa avviene può comunque essere duplice
Attacco di un forte nucleofilo direttamente al carbonio
Attacco di un nucleofilo più debole dopo un attacco elettrofilo di H+ all’ossigeno (catalisi acida).
L’esito può essere o di semplice addizione oppure si ha una ulteriore reazione dopo l’iniziale addizione.
Reazioni di addizione radicalica a C=O sono note ma, dato il carattere reversibile, più spesso è sfruttata la reazione inversa di frammentazione.
ADDIZIONI AD ALTRI LEGAMI DOPPI O TRIPLI
Addizioni ad altri legami doppi C=X (C=S ecc.) o tripli C=Y (C=N ecc.)
Anche in questi casi il legame insaturo è polarizzato perciò abbiamo generalmente:
Addizione nucleofila al carbonio.
Addizioni radicaliche.
Altre possibili reazioni di addizione sia per questo che per il precedente caso (C=O) rientrano in un’altra tipologia.