Le formula chimiche sono il modo che il chimico ha di rappresentare gli oggetti di cui si occupa, ovvero le molecole, evidenziandone caratteristiche costitutive utili per la comprensione delle stesse.
Sarebbe errato affermare che la funzione principale di una formula chimica sia quella di consentire di scrivere o menzionare in modo semplificato una molecola: se è vero che scrivere H2O è sicuramente più breve che scrivere “acqua” ed NaCl è più breve di “sodio cloruro”, la casistica più generale, specie quando si considera la chimica organica, smentirebbe clamorosamente questo modo di vedere le cose, in quanto è quasi la norma il fatto che una formula risulti più elaborata e detto concretamente “difficile da scrivere” che non il nome di una molecola, specie se per questa esiste un nome comune o volgare.
Prima di scendere maggiormente nel dettaglio relativo alle diverse tipologie di formule chimiche disponibili, è tuttavia necessario fare un doveroso distinguo di tipo linguistico fra due contesti scientifici totalmente distinti all’interno dei quali viene usata la parola “formula” con due significati nettamente diversi, con il risultato di generare talvolta nel lettore più inesperto una confusione di base che dev’essere assolutamente spazzata via prima di affrontare ogni altro approfondimento.
In fisica in primo luogo, ma anche il moltissime altre discipline scientifiche, applicazioni tecnologiche e perché no anche nella stessa chimica, esistono “formule” di tipo matematico che mettono in relazione quantitativa alcune entità misurabili con altre. Si tratta di fatto di equazioni algebriche, quindi di oggetti matematici, immediatamente identificabili per la presenza del segno = di “uguaglianza” posto fra i due membri di un’equazione. Se noi scriviamo E=mc2 significa che sostituendo ad E, ad m ed a c i loro valori numerici nelle relative unità di misura idonee, e svolgendo i calcoli richiesti (es. fra m e c c’è un segno di moltiplicazione implicito, c è elevato al quadrato…) si otterrà da una parte e dall’altra del segno di uguale lo stesso valore numerico. Se conosciamo solo i valori delle varabili che stanno in un membro, ovvero da un lato del segno di uguaglianza (nel caso dell’esempio se conoscessimo solo il valore di m e di c) la formula in questione ci consentirebbe di calcolare il valore esatto di E. Una relazione usatissima in fisica ma anche in chimica è “l’equazione di stato dei gas perfetti”, in formula pV=nRT: premesso ancora una volta il fatto che il non scrivere niente fra un simbolo e l’altro significa di fatto intendere che questi siano moltiplicati fra loro, possiamo qui vedere che la formula mette in relazione 5 diverse variabili o grandezze fisiche: p (pressione), V (volume), n (numero di moli), R (costante universale dei gas) e T (temperatura). Dopo esserci domandati quale unità di misura adottare per ciascuna variabile (es. pressione espressa in bar, volume in litri, n in numero di moli, R in … e T in gradi Kalvin), possiamo utilizzare la formula in questione per calcolare uno qualsiasi di questi 5 valori, avendo noti i 4 rimanenti, tramite rimaneggiamenti algebrici dell’equazione stessa. Ad esempio volendo calcolare il volume del gas in questione, otterremo: V=nRT/p e sostituendo di fatto n, R, T e p con i valori noti nello stesso sistema coerente di unità di misure, e svolgendo i relativi calcoli (moltiplicando n per R per T e dividendo per p) sarà possibile calcolare il valore di V.
Digressioni a parte, il concetto fondamentale è che le formule di questo tipo equivalgono a relazioni fra entità o grandezze fisiche diverse, sono di tipo quantitativo, e possono essere trattate con gli strumenti di calcolo messi a disposizione dalla matematica.
Parlando di formule chimiche ci troviamo invece in un ambito della conoscenza completamente diverso. Le formule chimiche sono da intendersi come delle pure rappresentazioni: a seconda dei criteri utilizzati (formula elementari, formula brute, formule di struttura, formule spaziali, ecc) potranno contenere ed evidenziare in modo esplicito un numero più o meno elevato di informazioni relative alla molecola alla quale si riferiscono, ma in un modo o nell’altro si tratta pur sempre di raffigurazioni stilizzate e convenzionali di un oggetto concreto, ovvero di una molecola, uno ione, un radicale o comunque di una qualche specie chimica. In questo in fondo una formula chimica non differisce molto dal punto di vista concettuale da un pittogramma o addirittura da un geroglifico: se volessimo rappresentare un uomo, potremmo disegnare l’omino con tanto di volto, espressione del viso, connotati e vestiti; semplificando potemmo limitarci a differenziare il maschio dalla femmina come nei simboli stilizzati utilizzati sulle porte dei servizi igienici pubblici; semplificando ancora di più potremmo delineare una figura umana unisex fatta solo da una linea per i corpo, una pallina per la testa e 4 trattini per braccia e gambe. Addirittura se volessimo sottolineare quanti esseri umani si sono un una stanza, magari per paragonarlo a quello dei cani che li accompagnano, potremmo estremizzare la semplificazione tracciando un trattino verticale per ciascun uomo, e magari vista la postura tipica dei cani, un trattino orizzontale per ogni animale quadrupede. Certo, in questo modo avremmo completamente perso le informazioni relative al sesso degli esseri umani presenti in quella stanza, al fatto che siano in piedi, seduti o coricati, ai tratti somatici del loro viso ed al loro abbigliamento, ma sappiamo che volendolo, con il tempo e lo spazio necessario sul foglio di carta, potremmo comunque rappresentare anche queste caratteristiche di dettaglio.
Anche per le formule chimiche possiamo scegliere il livello di generalizzazione o di dettaglio descrittivo che desideriamo, senza dimenticare mai uno dei concetti più importanti di questa disciplina, già per altro sviluppato in un altro post: quello per cui è la struttura stessa della molecola, ovvero gli atomi della quale è composta e la loro specifica organizzazione reciproca, a determinare univocamente le proprietà ed il comportamento della sostanza alla quale la molecola si riferisce, tanto che si dice che due molecole magari di orgine completamente diversa ma aventi di fatto la stessa struttura molecolare sono di fatto la stessa molecola.
Proviamo ad addentrarci nel mondo della rappresentazione molecolare mediante formule chimiche facendoci guidare dall’esempio di una molecola a noi molto vicina ma sulla quale come si vedrà i chimici si sono sbizzarriti ad adottare nel tempo metodi di rappresentazione diversi, in funzione di una sua effettiva complicazione strutturale di questa dolce molecola: il glucosio.
La formula chimica in assoluto più semplice è la cosiddetta formula elementare, detta appunto anche “minima”: essa ci dice semplicemente di quali elementi è fatta una molecola ed in che rapporto si trovano fra loro. La formula elementare del glucosio per esempio è CH2O che significa che è costituita da atomi di carbonio (C), idrogeno (H) ed ossigeno (O) e che per ogni atomo di carbonio presente ve ne saraò uno di ossigeno e due di idrogeno. Ma non di spiega se gli atomi rispettivamente di C, H ed O sono di fatto 1, 2, 1 oppure 2, 4, 2 o anche 3, 6, 3 o altre combinazioni analoghe.
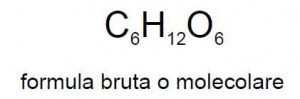
Un livello di definizione solo leggermente superiore è quello della formula bruta: in essa non si riportano semplicemente i rapporti relativi fra i diversi elementi contenuti, ma il numero effettivo ed esatto di ciascuno di essi.
La formula bruta del glucosio per esempio è C6H12O6. Come si vede essa rappresenta un caso specifico all’interno del rapporto 1, 2, 1 che appunto era indicato dalla formula elementare prima riportata.
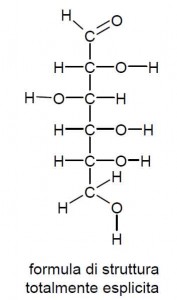
Un salto di livello descrittivo lo abbiamo invece quando iniziamo ad interessarci della struttura della molecola, ovvero di come sono legati fra loro i diversi atomi che compongono la molecola. La formula di struttura evidenzia proprio come questi atomi sono organizzati fra loro attraverso legami chimici.
Qui sotto per esempio è riportata una formula di struttura che si potrebbe definire “completamente esplicita” per il glucosio, dove cioè sono riportati tutti gli atomi che compongono la molecola di glucosio anche quelli che il chimico riterrebbe più scontati, separati uno dall’altro da legami, che nello specifico potranno essere di tipo semplice o doppio. Nello specifico si osserva, come è giusto che sia in relazione alle relative valenze, che il carbonio stringe complessivamente 4 legami, l’ossigeno 2 e l’idrogeno 1 soltanto.
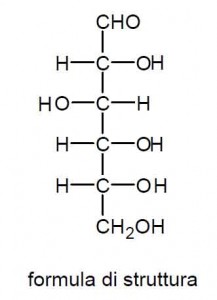
Per la stragrande maggioranza dei contesti operativi però questa formula di struttura (o come si dice in linguaggio chimico semplicemente “struttura”) risulta eccessivamente appesantita, complessa da scrivere e piena di particolari che, oltre ad essere nel complesso poco informativi, rischiano di distogliere l’attenzione visiva dalle parti più salienti della molecola.
Ecco allora che si può procedere a semplificare questo tipo di rappresentazione con alcuni accorgimenti convenzionali. Uno dei più frequenti è quello di identificare gruppi di atomi legati fra loro in modo tipico e caratteristico, ovvero ricorrente in moltissime strutture molecolari: questi gruppi di atomi prendono il nome di gruppi funzionali. Nella struttura qui a lato, sempre riferita al glucosio, sono stati sostituiti due diversi raggruppamenti di atomi, uno nell’estremità superiore e l’altro in quella inferiore della molecola, con due notissimi gruppi, rispettivamente il CHO (detto gruppo aldeidico) ed i CH2OH (detto gruppo alcolico primario). Inoltre gli atomi di idrogeno legati ad un ossigeno sono stati rappresentati fusi con questo in un altro piccolo gruppo funzionale OH.
Un ultimo grado di semplificazione, molto in voga negli ultimi anni specie fra gli addetti ai lavori, è quello di sottintendere ciascun atomo di carbonio, facendolo graficamente “scomparire” dalla formula di struttura: al suo posto si vedranno semplicemente i legami che esso stabilisce, quasi come se nella rappresentazione esso fosse diventato così piccolo da essere praticamente puntiforme. In questo contesto di semplificazione anche gli atomi di idrogeno H legati direttamente al carbonio vengono eclissati, risultando per il chimico scontati dal momento che si sa che ogni C dovrebbe stringere comunque 4 legami, quindi ogni legame mancante è intenso come un legame con idrogeno.
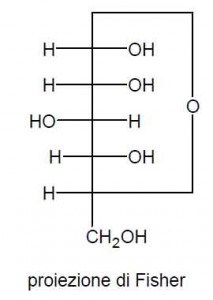
Se da un lato il chimico sente il bisogno di semplificare la rappresentazione grafica della struttura di una molecola, eliminandone gli inutili fronzoli e mettendo in risalto gli eventuali punti salienti, dall’altra parte gli tocca fare i conti con il fatto che il foglio di carta sul quale scriverà la formula, così come il monitor del PC nel caso di una rappresentazione via software, è pur sempre una superficie bidimensionale, mentre la maggior parte delle molecole sono degli oggetti perfettamente tridimensionali. In certi casi la proiezione bidimensionale sul piano del foglio della molecola non porta a grosse distorsioni o semplificazioni eccessive, mentre in altri casi quello che ne risulta a livello grafico può apparire davvero paradossale. Nell’esempio riportato qui a lato si è partiti ancora una volta dalla nostra molecola di glucosio: in natura è normale che una molecola di glucosio, come quella della maggior parte degli altri monosaccaridi, vada incontro ad una reazione intramolecolare detta di semiacetalizzazione dove le due estremità della molecola interagiscono fra loro con l’eliminazione di una molecola di acqua e la formazione di un anello chiuso. La struttura così formata prende anche il nome di struttura semiacetalica del glucosio. Ma come si può rappresentare graficamente l’unione tramite un nuovo legame chimico di due atomi posti in zone inizialmente lontane sulla stessa molecola? L’esempio riportato in figura (chiamato anche proiezione di Fisher) non è certamente il più soddisfacente in quanto indica sì quali sono gli atomi che si legano fra loro ed in che modo, ma non fornisce affatto un’idea realistica, ovvero una rappresentazione pittografica, per quanto semplificata, della nuova forma che verrà ad assumere la molecola: non è infatti realistico pensare che i nuovi legami formati dalla reazione siano almeno 5 volte più lunghi di tutti gli altri presenti sulla stessa molecola! Cosa succede in realtà è che, esattamente come quando si congiungono gli estremi di una catena, la molecola si chiude ad anello, o meglio ancora in un poligono avente per vertice un atomo di carbonio ed eventualmente di ossigeno.
Molto più soddisfacente è invece questo altro tipo di rappresentazione, noto come stereo-proiezione. Oltre alla struttura poligonale chiusa ad anello (dove i lati e quindi i legami hanno lunghezza paragonabili fra loro), questo tipo di rappresentazione di una struttura molecolare evidenzia un’altra informazione importantissima, qualcosa che inizia, seppur timidamente, a dare un carattere di profondità alla struttura anche nella terza dimensione. Dagli atomi di carbonio “sottintesi” ai vertici dell’esagono partono infatti dei legami con il gruppo OH che possono essere rappresentati con triangolini neri pieni (ed in questo caso l’OH legato si trova proiettato sopra il piano del foglio) o con triangolini tratteggiati (ed in questo caso l’OH legato si trova proiettato al di sotto del piano). Tutto il resto della molecola, ovvero l’esagono stesso e gli eventuali altri legami di forma tradizionale a trattino, si intendono semplicemente coincidenti con il piano del foglio.
Una prospettiva a prima vista inversa rispetto a quella appena descritta è rappresentata dalle proiezioni secondo Haworth, dal nome del chimico che iniziò ad introdurle, specie nell’ambito dei carboidrati come appunto il glucosio.
Le formule di struttura di Harwoth rappresentano la struttura con l’anello in prospettiva, come se attraversasse il foglio: nelle rappresentazioni più raffinate si vedrà la parte più vicina al lettore, ovvero al di sopra del piano del foglio, tracciata con segni più marcati, in grassetto, e la parte più lontana tracciata con segni grafici più fini; in una rappresentazione più semplificata questa accortezza non è talvolta rispettata ma si continua a vedere l’anello “in prospettiva”, ovvero in questo caso come un esagono schiacciato: in questo caso la parte anteriore, quella che esce idealmente al di sopra del piano del foglio è comunque quella che si trova più in basso.
Nelle formula di Haworth i vari sostituenti come H, OH, CH2OH, ecc sono sistemati parallelamente al piano del foglio, evidenziando il fatto che si trovino al di sopra piuttosto che al di sotto del piano dell’anello.
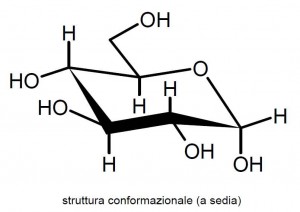
Un ulteriore e per lo più decisivo salto di qualità (ma ahimè anche di difficoltà di scrittura!) lo si ha con le formule di struttura che mostrano la cosiddetta conformazione molecolare, ovvero gli atomi ed i legami in una posizione più naturale e rispettosa della forma effettiva della molecola. La maggior parte delle molecole infatti non è rigida ma al contrario, specie in soluzione (ad esempio per lo zucchero, in soluzione acquosa) o allo stato di vapore, si muove flettendosi intorno ad alcuni punti di snodo, che nel caso del glucosio dell’esempio sono tutti gli atomi di carbonio e quello di ossigeno che fanno parte dell’anello esagonale. Molecole lineari aperte o chiuse ad anello, salvo alcuni casi particolari, sono libere di fluttuare intorno alle loro “articolazioni”, pur senza modificare disposizione e lunghezza dei legami presenti. Certe posizioni (che il chimico è solito chiamare conformazioni), e quindi certe forme spaziali della stessa molecola, spesso anche semplicemente una soltanto, possono però risultare particolarmente favorite in quanto ad esse corrispondono condizioni di più elevata stabilità, come se in esse la molecola risultasse per così dire “più comoda”: più correttamente dovremmo dire che queste conformazioni corrispondono al minimo di energia interna alla molecola.
Utilizzando tutti gli accorgimenti grafici necessari, si può tentate di rappresentare in figura una specifica conformazione di una molecola: nel caso del glucosio nella consueta forma chiusa (alfa-D-glucupiranosio) qui in figura si è scelto di rappresentare la conformazione energeticamente più stabile, quindi quella più favorita, in soluzione acquosa, che nello specifico degli anelli a sei atomi prende il nome di conformazione “a sedia”.
In queste rappresentazioni conformazionali valgono sempre le stesse convenzioni di tratteggio fine o marcato che permettono al lettore di comprendere a colpo d’occhio quale parte dell’anello stia davanti o dietro al piano del foglio; in aggiunta in questo caso l’anello stesso non risulta appiattito ma sua volta articolato, segmentato come uno zig-zag, ed in generale diventa quasi impossibile trovare due legami disposti linearmente uno di seguito all’altro: anche questo rende giustizia del fatto che i legami nella realtà non partono da un atomo (nello specifico da un atomo di carbonio) in modo casuale o flessibile, ma sono direzionati in modo molto ben preciso nello spazio.
Anche gli atomi o i gruppi di atomi che sono posizionati sull’anello, quindi gli H, gli OH ed i CH2OH, sono disposti alcuni in direzione verticale al di sopra o al di sotto dell’anello (e queste posizioni prendono il nome di assiali), altri quasi orizzontalmente allineati con il piano stesso dell’anello (queste posizioni prendono invece il nome di equatoriali).
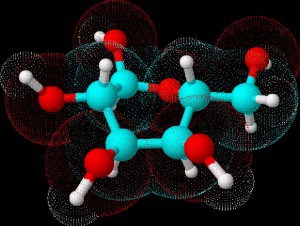
Oltre questo livello di rappresentazione inizia il campo dell’autentica raffigurazione tridimensionale delle molecola, operazione che risulterebbe pressoché impossibile, o se non altro sorprendentemente ardua, senza l’ausilio di un computer e di software specificamente sviluppati per la modellazione molecolare. La rappresentazione qui riportata è una delle più semplici e per certi versi “banali” che risultano oggi possibili, e mostra ancora una volta il nostro glucosio in forma chiusa, fra l’altro nella stessa conformazione a sedia precedentemente descritta, con gli atomi rappresentati sotto forma di sferette di colori diversi (azzurro per il carbonio, rosso per l’ossigeno e bianco per l’idrogeno) ed i legami sotto forma di cilindretti sottili di giunzione. La cosa più interessante in questa rappresentazione è però costituita dalle sfere più grandi e qui appena tratteggiate, del colore del rispettivo atomo al quale si riferiscono e che dovrebbero in qualche modo approssimare il volume di spazio occupato da ciascun atomo (il raggio di ciascuna di queste sfere prende il nome di raggio di Van der Waals). Come si può intuire dall’immagine, le sfere sono parzialmente fuse l’una con l’altra e, se si fosse scelto di rappresentarle come volumi pieni, ovvero di superficie opaca, il risultato sarebbe stato quello di oscurare buona parte dei restanti atomi della molecola: una soluzione questa sicuramente ottimale per lo “studio” delle molecole, ma probabilmente non per la loro semplice rappresentazione grafica.