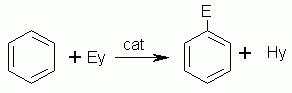La reazione tipica del benzene, a differenza di quanto avviene nei composti che presentano legami saturi od insaturi, è di sostituzione. Lo schema di una reazione generica del benzene è il seguente
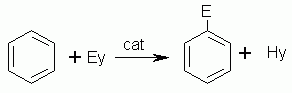
Il catalizzatore si rende necessario in quanto, a differenza di quanto avviene negli alcani e negli alcheni, la molecola non si divide per interazione con il singolo o doppio legame proprio perchè il legame del benzene è di tipo delocalizzato. Mediante il catalizzatore, che solitamente è un acido di Lewis, la molecola subisce una scissione eterolitica che, nel caso dell’esempio generico, è la seguente
La particella elettrofila E+ attacca l’anello benzenico formando un carbocatione ibrido di tre formule limite, dove la carica è localizzata nelle posizioni orto e para. Dopo aver attaccato l’anello la schematizzazione visiva è la seguente
Successivamente la particella nucleofila (y–) strappa l’idrogeno prossimale ad E, il legame C-H pertanto non ha più modo di esistere e gli elettroni si trasferiscono nell’anello benzenico. L’aromaticità del composto è ripristinata e la sostituzione elettrofila è stata compiuta. La regola generale è, pertanto, la seguente