L’addizione di acido nitrico al metilbenzene forma tre isomeri sostituiti presenti in miscela in quantitativi differenti. Questa peculiarità fa si che il metilbenzene, in virtù del gruppo metilico, sia attivato ed orientato in posizioni para ed orto ma non meta.
La reazione generica per aggiungere un gruppo nitro al metilbenzene, o toluene, è la seguente. Si ricorda che il metilbenzene reagisce più velocemente del benzene in virtù del gruppo metilico che è un gruppo attivante
La resa del composto è quantitativamente differente in termini di isomeri poichè si assiste ad una prevalenza orto- e para-, rispettivamente del 59% e 37%, a discapito di un piccolissimo quantitativo di meta-, di circa il 4%.
Questo fenomeno è spiegabile mediante l’analisi dell’attacco di NO2, derivante dall’acido nitrico per reazione con acido solforico. Il diossido d’azoto, infatti, rende il toluene più stabile in posizione orto- e para- e meno stabile, e quindi meno presente, quando legato in posizione meta-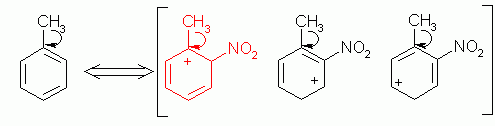
Questo fenomeno è spiegabile mediante l’analisi dell’attacco di NO2, derivante dall’acido nitrico per reazione con acido solforico. Il diossido d’azoto, infatti, rende il toluene più stabile in posizione orto- e para- e meno stabile, e quindi meno presente, quando legato in posizione meta-

Il gruppo metilico è attivante, per cui può trasferire gli elettroni verso l’anello del benzene. L’attacco del diossido d’azoto impoverisce il benzene che si presenta in tre formule limite. In una di queste, quella in figura marcata di rosso, la zona elettronpovera (+) cerca elettroni e il metile è direttamente collegata ad essa per cui si ha una maggiore stabilità del prodotto ortosostituito del benzene. Lo stesso ragionamento può essere applicato per il prodotto parasostituito.
Il prodotto metasostituito, invece, non ha cariche localizzate vicino al metile e per questo motivo si presenta in minore quantità.
