Il legame chimico è l’interazione che tiene uniti atomi e molecole. Grazie al legame chimico è possibile la presenza dei composti ed, in generale, della materia.
Esistono due categorie di legami chimici che si differenziano in base al tipo di interazione: il legame primario e il legame secondario. Il legame primario tiene uniti gli atomi all’interno di una stessa molecola come, per esempio, quella dell’acqua mentre il legame secondario tiene coese le molecole come avviene, per esempio, nell’amido.
I legami fondamentali, che si vengono a instaurare tra gli atomi di una stessa molecola, sono il legame covalente, ionico e metallico. I legami secondari sono il legame dipolo-dipolo, ad idrogeno e il legame apolare.
L’energia di legame.
Per rompere un legame è necessario fornire dell’energia alla molecola e, mediante l’analisi dell’energia dispensata, è possibile quantificare l’energia di legame. In altre parole l’energia di legame è
Tale quantitativo energetico, proprio perchè si riferisce alla mole, viene espressa in kJ/mol. I legami forti hanno un alta energia di legame mentre i legami deboli hanno una bassa energia di legame. Ciò vuol dire che basta somministrare un modesto quantitativo di energia per rompere un legame ad idrogeno come quello dell’acqua-acqua (circa 10-40 kJ/mol) ma tale valore cresce se si vogliono rompere legami covalenti singoli, doppi o tripli (in H-F è di circa 570 kJ/mok)
Formazione del legame.
Per quale motivo un legame si forma? La risposta a tale domanda fu data agli inizi del XX secolo dal chimico americano Lewis secondo il quale il legame si forma per garantire alle molecole l’ottetto elettronico di stabilità s2p6 simile a quello del gas nobile che li segue o li precede. Prendiamo ad esempio l’ossigeno, che ha numero atomico 8 (otto elettroni) e configurazione 2s2 2p4. Il gas nobile che lo segue è il neon 1S2 2S2 2P4 pertanto la configurazione che tende ad assumere l’ossigeno sarà proprio quella del neon.
In questo modo gli elettroni spaiati in 2P formano un legame di tipo covalente doppio e raggiungono pertanto l’ottetto del neon.
Legame covalente.
Abbiamo già visto un legame covalente doppio (O=O) che è il risultato della compartecipazione di quattro elettroni, due per ogni atomo. Nel caso dell’ossigeno molecolare (O2) ogni ossigeno mette in compartecipazione i due elettroni spaiati formando due legami covalenti. Ma che fine fanno questi elettroni e, in particolare, a quale elemento appartengono? La risposta è semplice: gli elettroni in un legame covalente non vengono posseduti da nessun atomo coinvolto nel legame ma restano in compartecipazione. In altre parole, nel singolo legame, l’elettrone è allo stesso tempo proprio dell’atomo ma in compartecipazione dell’altro. Il doppio legame è la messa in compartecipazione di due elettroni per atomo, mentre il triplo legame è la compartecipazione di tre elettroni per atomo.
Il legame covalente polare.
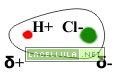
Se il legame covalente non avviene tra elementi con la stessa elettronegatività il legame può diventare polare. Prendiamo il caso dell’acido cloridrico HCl i cui atomi hanno una diversa elettronegatività. Il cloro è più elettronegativo dell’idrogeno ed attrae a se gli elettroni formando una nube elettronica più ampia. L’idrogeno è meno elettronegativo e, di conseguenza, cede elettroni con più facilità.
La polarità delle molecole ha conseguenze sul comportamento di esse in quanto possiede un eccesso di carica in una zona ed un difetto in un altra. L’acqua è anche una molecola polare.
Legame covalente dativo.
Nel legame covalente dativo un atomo mette a disposizione due elettroni che vengono trasferiti ad un altro atomo che, invece, fornisce l’orbitale libero su cui stazionare.
Legame ionico
Nel legame ionico due atomi hanno una differenza di elettronegatività superiore a 1.9 e, per questo motivo, gli elettroni di legame confluiscono verso l’atomo più elettronegativo. E’ un legame di natura elettrostatica in quanto gli atomi tendono a diventare ioni come nel caso del cloruro di sodio
Legame metallico.
Il legame metallico è dovuto alla delocalizzazione negli elettroni in un reticolo formato da elementi metallici. Il legame metallico non forma delle vere e proprie molecole visto che gli elementi sono attratti da cariche elettrostatiche ma conferisce al metallo, o alla lega in minor misura, delle eccezionali capacità conduttive sia dell’elettricità sia del calore. Gli elettroni, infatti, non essendo “ancorati” a nessun atomo sono relativamente liberi di circolare lungo il reticolo.