Quando si pongono due o più reagenti, se le condizioni lo permettono, si verifica una reazione che trasforma tali reagenti in prodotti. Le reazioni chimiche possono essere di sostituzione e di ossidoriduzione. Nelle reazioni di sostituzione avviene che gli atomi, o i gruppi, si mescolano tra loro senza variare il proprio stato di ossidazione cosa che avviene, a differenza, nelle reazioni di ossidoriduzione.
In alcune reazioni, tuttavia, i reagenti diventano prodotti i quali, a loro volta, reagiscono tra loro tornando a formare i prodotti in iniziali. In queste reazioni, che si definiscono di equilibrio, i prodotti ed i reagenti tendono a uniformare le loro concentrazioni rendendole costanti durante un arco di tempo indefinito. In altre parole la concentrazione dei prodotti e dei reagenti si assesta su un valore e rimane costante fino a che qualche parametro del sistema non viene variato.
Nella chimica industriale le reazioni di equilibrio sono di fondamentale importanza in quanto possono essere operate per produrre continuamente delle specie chimiche immettendo un flusso di reagenti in un reattore. Questa affermazione è valida a patto che sia la temperatura sia la pressione rimangano costanti perchè, come in ogni reazione chimica, anche la reazione di equilibrio è fortemente influenzata dalla pressione e dalla temperatura. Una maggione pressione, una maggiore temperatura od entrambi determinano una maggiore velocità di creazione dei prodotti che, pertanto, permangono in concentrazioni maggiori. All’opposto una minore temperatura, od una minore pressione, rendono la reazione più lenta e pertanto l’equilibrio rimane spostato verso i prodotti per un arco di tempo maggiore.
Le reazioni di equilibrio.
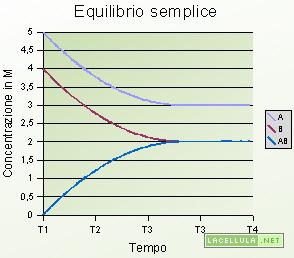
Se poniamo A e B sono due prodotti e la loro reazione forma AB tale reazione è, come è già stato detto, irreversibile. Se il prodotto AB si dissocia allora la reazione è di equilibrio in quanto, alle stesse condizioni in cui avviene la reazione, si nota che le concentrazioni dei prodotti (A e B) diminuiscono all’aumentare della concentrazioni di AB; le concentrazioni se non avvengono fenomeni esterni si stabilizzano in un punto definito punto di equilibrio che, ovviamente, varia a seconda delle specie presenti nella reazione.
Nell’esempio sopra proposto la concentrazione è espressa in molarità (numero di moli su un litro di solvente). Quando sono presenti solo i reagenti la concentrazione molare è pari a 5 per la specie A, 4 per la specie B e 0 per AB. La specie AB, infatti, non si è ancora formata e all’inizio dell’equilibrio non è presente. Dopo l’inizio della reazione si consumano un quantitativo di moli di reagenti A e B mentre si formano un quantitativo di moli del prodotto AB. Dopo un certo periodo (che nel grafico è rappresentato in T3,5) le concentrazioni restano costanti pertanto si è raggiunto l’equilibrio.
La variazione delle concentrazioni dei prodotti/reagenti può essere calcolata mediante uno specchietto che riporta in alto la reazioni e, successivamente, il numero di moli iniziali, la variazione e il numero di moli all’equilibrio.
| A | B | AB | ||
| I | 5 | 4 | 0 | |
| V | -x | -x | +x | |
| Eq | 5-x | 4-x | +x |
In questo esempio conoscendo il numero di moli iniziali su litro, quindi la concentrazione molare, e il numero di moli finali di una specie, ad esempio A, a patto che temperatura e pressione rimangono costanti, si calcola il valore dell’incognita x semplicemente svolgendo
e di conseguenza è possibile ottenere, sostituendo all’incognita x il valore appena calcolato, ogni aspetto della concentrazione dell’equilibrio.
Equilibri in presenza di coefficienti stechiometrici.
Il calcolo dei valori all’equilibrio varia se i reagenti od i prodotti presentano coefficienti stechiometrici. In questo caso il calcolo dell’equilibrio si opera nel seguente modo:
| A | 2B | 3AB | ||
| I | 5 | 4 | 0 | |
| V | -x | -2x | +3x | |
| Eq | 5-x | 4-2x | +3x |
E’ opportuno ricordare che i valori noti e le incognite devono essere espresse in molarità e, pertanto, se il volume del reattore è differente da un litro si deve calcolare la molarità di ogni specie.
La costante Kc di equilibrio.
Una volta all’equilibrio la reazione presenta delle concentrazioni che, durante il tempo, si mantengono costanti. Il rapporto tra le concentrazioni, pertanto, è costante e si calcola elevando la concentrazione della specie all’eventuale coefficiente stechiometrico. Nel caso dell’equilibrio senza coefficienti stechiometrici
la costante di equilibrio Kc è