Nel 1930, Linus Pauling, propose un nuova teoria per spiegare i legami chimici covalenti che non considerava necessario il riempimento dell’ottetto, da parte degli atomi coinvolti, ma la compartecipazione degli orbitali. Gli orbitali degli elementi, infatti, si sovrappongono nello spazio tridimensionale e l’attrazione determina la formazione del legame.
Secondo la teoria del legame di valenza (VB) gli orbitali che si sovrappongono sono quelli in cui figura il singoletto (un elettrone spaiato) che appaiandosi con un altro singoletto di spin opposto satura l’orbitale rendendo possibile il legame. La forza del legame dipende sia dato tipo di sovrapposizione sia dal numero. Secondo Pauling, infatti, tra due atomo potevano essere distinti due sovrapposizioni: σ e π. Il legame σ (sigma) è più forte rispetto al legame π (pi greco). La differenza tra i due legami è da ricercare nel modo con il quale gli orbitali si incrociano: se lo fanno lungo l’asse ideale dei due atomi allora il legame è di tipo σ, altrimenti è di tipo π.
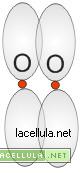
Legame σ nella molecola H2.
Secondo la teoria del legame di valenza l’idrogeno gassoso presenta un legame di tipo σ . L’idrogeno ha configurazione 1S1 e pertanto presenta un solo elettrone che forma una nube sferica.
L’orbitale si incrocia e la forma della molecola di H2 è la seguente
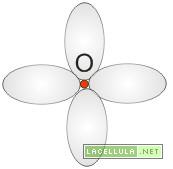
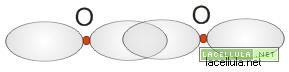
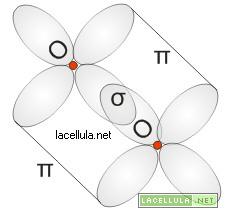
Il legame della molecola di ossigeno (O2) è di tipo misto in quanto subentra un legame π ed un legame σ. Il perchè di questi due legami è spigabile ricordando, graficamente, la nube elettronica dell’ossigeno