Indice
La teoria atomica di Bohr, in unione con le leggi della fisica quantistica e, in particolare, con gli approfondimenti riguardanti i numeri quantici atomici danno una idea molto completa su come gli elettroni si configurano attorno al nucleo.
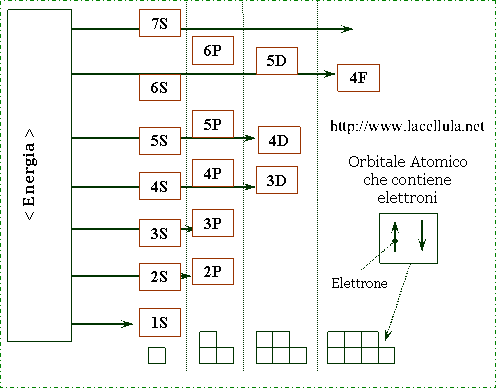
Gli elettroni non possono essere presenti in ogni zona dello spazio ma, ad essi, viene assegnata una “porzione” corrispondente al loro livello energetico. Tale porzione, o orbitale, rappresenta una energia maggiore allontanandosi dal nucleo, pertanto, gli orbitali più interni sono a minore energia e quelli più esterni possiedono una maggiore energia.
Dalle considerazioni quantistiche sull’atomo si ricava che il primo livello energetico possiede un solo orbitale (1s) il secondo livello energetico possiede due orbitali 2s e 2p, il terzo livello due orbitali e via dicendo. Per configurare correttamente la componente elettronica di un atomo si deve tener conto di tre aspetti: la legge di esclusione di Pauli, il riempimento a minire energia e la regola di Hund.
Legge di esclusione di pauli.
Il riempimento degli orbitali, inoltre, segue la legge di esclusione di Pauli che afferma:
Disposizione a minor energia.
In aggiunta l’aufbau (dal tedesco costruzione) della componente elettronica di un atomo tiene conto che gli elettroni tendono a disporsi nel primo orbitale libero con la più bassa di energia.
Regola di Hund.
La regola di Hund afferma che in caso di orbitali degeneri (2s-2p,3s-3p,4s-4p-3d …) gli elettroni si dispongono con spin parallelo
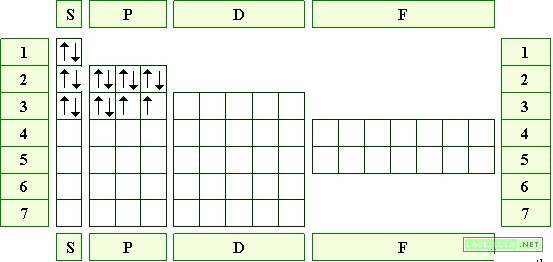
Configurazione elettronica dell’ossigeno
L’ossigeno ha configurazione elettronica 1S2 2S2 2P4. Gli elettroni nell’orbitale degenero 2P seguono la regola di Hund e pertanto sono disposti in modo parallelo ad eccezione del primo.
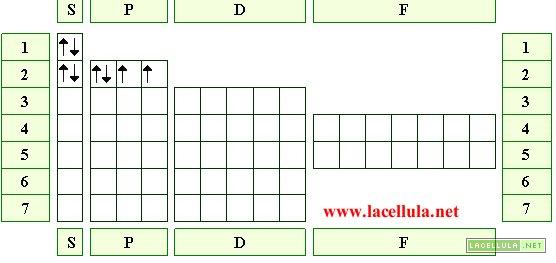
Configurazione elettronica dello zolfo
Lo zolfo ha numero atomico (Z) 16 e, per questo motivo, possiede 16 elettroni che si dispongono lungo gli orbitali. La disposizione degli elettroni segue le classiche regole e, di conseguenza, il primo orbitale ad essere riempito è 1S per poi procedere a riempire i livelli energetici superiori.
A seguito della configurazione è possibile illustrare lo zolfo, secondo Lewis, nel seguente modo