Indice
Fu il chimico francese Louis Camille Maillard a descrivere per primo nel 1910 una curiosa reazione che, coinvolgendo due delle principali classi di costituenti più diffusi nei prodotti di origine naturale, gli aminoacidi (mattoncini di base che a loro volta costituiscono le proteine) e gli zuccheri semplici (che possono a loro volta liberarsi dai carboidrati complessi), era in grado di portare alla formazione di alcuni prodotti di reazione fino ad allora sconosciuti.
Suppongo che il dottor Maillard fu probabilmente un pò infastidito, almeno in un primo momento, da questa sorta di reazione collaterale, in quanto lo scopo iniziale del suo lavoro era semplicemente quello di giungere alla sintesi in laboratorio delle proteine di interesse biologico, una cosa detto fra noi tutt’altro che semplice. Con tutta probabilità egli dovette notare, durante i suoi tentativi di sintesi, che quando degli aminoacidi non completamente depurati dagli zuccheri riducenti (quasi sempre presenti almeno in tracce nei prodotti di origine naturale) venivano riscaldati, specie se in carenza di acqua, almeno una parte di questi aminoacidi si perdeva, trasformandosi in qualcos’altro, qualcosa di probabilmente di colore più scuro e sicuramente molto odoroso.
Da qui ad intuire che questo tipo di trasformazione poteva rivestire un ruolo fondamentale nello spiegare come si originano le molecole aromatiche durante la cottura degli alimenti il passo non fu enorme, non così grande almeno come il cercare in seguito di decifrare nei dettagli cosa effettivamente succedeva nel corso di queste reazioni, che si dimostrarono un rompicapo veramente al di sopra di ogni aspettativa.
Uso non a caso il plurale: quelle che infatti presero da allora il nome di “reazioni di Maillard” non sono semplicemente “una” ma una vera moltitudine di possibili reazioni che, partendo da un numero tutto sommato modesto di molecole fra loro diverse inizialmente presenti negli ingrediente (poco più di una ventina sono gli aminoacidi proteici, ancora meno quelli suscettibili di questo tipo di reazioni, e non più di mezza dozzina i più diffusi zuccheri semplici riducenti) sono in grado di generare una vera moltitudine di specie chimiche diversificate. Come una piccolo ruscello di montagna che si tuffa su una scarpata ripida e pietrosa, le reazioni di Maillard possono seguire percorsi molteplici, spesso simultanei fra loro: lo stesso tipo di molecola può infatti andare incontro a destini diversificati, alcuni alternativi fra loro, altri paralleli. Alcuni di questi percorsi reattivi convergono sullo stesso prodotto finale, altri divergono dando ragione della generazione di prodotti diversi, in parte specifici in relazione alle molecole di partenza, altri alle condizioni di reazione (temperatura, pH, umidità, catalizzatori, altre molecole presenti, ecc), fino alla generazione finale di un pool estremamente complesso di prodotti di reazione, costituito anche da diverse centinaia di molecole. Un bel casino direbbe qualcuno, ma la cosa straordinaria è che nonostante questa elevata complessità, partendo dagli stessi ingredienti iniziali (quindi dalle stesse molecole ed in rapporti simili) e lavorando nelle stesse condizioni operative (es. temperatura, umidità, tecnica di cottura, acidità, ecc) si arriva ad ottenere un insieme di molecole-prodotto che, per quanto molto complicato, è comunque piuttosto costante e riproducibile, tanto da consentirci di riconoscere con facilità a quale alimento appartiene.
La consapevolezza da un lato dell’importanza, dall’altro della complessità dell’argomento è cresciuta negli anni a tal punto da motivare la creazione di una società scientifica internazionale specificamente dedicata all’argomento, l’International Maillard Reaction Society (IMARS).
(citazione da Wikipedia): “Si tratta di un’ organizzazione internazionale senza fini di lucro fondata nel 1985 e che raggruppa ricercatori, accademici, medici, studenti, interessati al campo della Reazione di Maillard nel cibo, nella biologia e nella medicina. La rete costituita dalla associazione IMARS mira a favorire il trasferimento di conoscenze tra scienziati che operano in campi completamente diversi, scienziati che non si incontrerebberoche non si incontrano mai nel corso di riunioni scuentifiche convenzionali. La missione fondamentale della associazione è quella di promuovere la ricerca di alta qualità per la Reazione di Maillard. L’IMARS organizza ogni 3 anni un “Simposio Internazionale sulla Reazione di Maillard”. Il prossimo Simposio si terrà nel 2012, a 100 anni dal principale lavoro sulla Reazione di Maillard. Il Simposio si terrà a Nancy, la città di Louis Camille Maillard.”
AROMI DA COTTURA SENZA MAILLARD
A dire il vero si commetterebbe un errore se a questo punto si affermasse che tutte le molecole che contribuiscono all’aroma che un alimento sviluppa durante da cottura si originano a partire dalla combinazione di uno zucchero riducente e di un aminoacido o di loro derivati.
In realtà una grande quantità di molecole fra le quali zuccheri semplici, acidi grassi insaturi, nucleotidi derivanti dall’RNA, composti solforati, vitamine, aminoacidi possono trasformarsi singolarmente o reagendo fra loro secondo una successione di reazioni diverse da quelle dette appunto di Maillard.
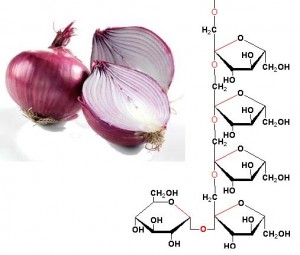
L’esempio più banale che possa venirmi in mente riguardante la trasformazione di molecole inizialmente presenti negli ingredienti, con la formazione di prodotti in grado di incidere sulle qualità organolettiche del prodotto è quella dell’idrolisi dell’amido e dei polisaccaridi in generale. Dalla pasta al riso alle patate, è noto che una cottura sufficientemente prolungata in presenza di acqua “intacca” almeno in parte la struttura dell’amido, modificandone in parte la conformazione tridimensionale e quindi la consistenza del prodotto, ma liberando anche mono- e oligosaccaridi che contribuiscono all’accrescimento della nota naturalmente dolce degli alimenti amidacei cotti, come ad esempio la pasta e le patate. Il fenomeno è favorito da un pH acido, per cui se si desidera incrementare la dolcezza di un prodotto amidaceo durante la cottura, anche se questo con tutta probabilità andrà un po’ a scapito della sua struttura, si può acidificare leggermente l’acqua di cottura, ad esempio con succo di limone, aceto o sughetti di verdure acide con quello di pomodoro. E’ vero che nel prodotto finito l’acidità potrebbe coprire un po’ la percezione del dolce, ma basterà aggiungere una minima quantità di bicarbonato per annullare la prima e di conseguenza permettere agli zuccheri liberati di farsi apprezzare in tutta la loro dolcezza. Diverse verdure contengono polisaccaridi diversi dall’amido, come ad esempio l’inulina, presente nelle cipolle, nell’aglio e nel topinambur, costituita da catene di fruttosio: l’idrolisi di questo polisaccaride genera fruttosio libero, di dolcezza specifica ancora più elevata rispetto a quella del glucosio.
La degradazione al quale va incontro il comune zucchero domestico (saccarosio) quando è fatto fondere, eventualmente con una traccia di succo di limone per abbassare il pH, per formare caramello: questo è un esempio di reazione di pirolisi terribilmente complicata ma che riguarda solo e soltanto una tipologia di molecola di partenza, il saccarosio appunto, e per quanto origini un prodotto multi-componente dotato di aroma, colore e consistenza caratteristici, il caramello, non può essere annoverata fra le reazioni di Maillard.
Da notare che alcuni prodotti tipici della disidratazione degli zuccheri caratteristi dell’aroma di caramello, come ad esempio il furfurale ed il 5-idrossimetilfurfurale possono derivare sia dai monosaccaridi in modo diretto (senza la partecipazione di aminoacidi), a patto che il pH sia acido, che a pH neutro o basico seguendo un percorso classificabile come reazioni di Maillard, in presenza di aminoacidi e con una resa più elevata. Nel caso del decorso diretto, quello che non comporta la partecipazione di aminoacidi, risultano favoriti gli zuccheri cosiddetti “pentosi”, ovvero a 5 atomi di carbonio, come lo xilosio, molto diffuso negli ingredienti di origine vegetale specie in quelli “integrali”, con la formazione del furfurale (che oltre che a contribuire all’aroma è però penalizzato per ragioni tossicologiche che possono subentrare ad elevate concentrazioni della molecola).
Da qui si comprenderà come non sia facile in taluni contesti “raccontare” l’origine di una molecola, che può derivare da scenari reattivi e da composizioni iniziali anche molto differenti.
Altri importanti casi, questi sì più complessi e diffusi in natura anche a prescindere dalla mano del cuoco, riguardano la degradazione di acidi grassi mono- o polinsaturi, attraverso meccanismi che prevedono l’ossidazione, la rottura della catena dell’acido grasso in frammenti più piccoli ed eventualmente trasformazione di questi frammenti in molecole più volatili ed intensamente odorose (aldeidi e chetoni). Anche se con decorsi diversi, questa classe di reazioni avviene in tutti gli esseri viventi, uomo compreso, e trova fra i suoi promotori tanto enzimi naturalmente presenti negli organismi (le lipoossigenasi) che i famigerati radicali liberi (che in fondo sono una forma attiva dell’ossigeno, attraverso la quale quello gassoso dell’atmosfera riesce ad entrare in molte molecole biologiche, con i noti danni che ne conseguono) che eventuali tracce di metalli pesanti, come ad esempio il rame ed il nichel.
In molti vegetali, già in campo ma soprattutto durante la loro preparazione in cucina, la presenza di aria, dalla luce e del calore, nonché di tracce di metalli quasi sempre presenti negli attrezzi di cucina, favorisce questo tipo di reazioni, spingendole fino all’estrema conseguenza della formazione di aldeidi volatili ed intensamente profumate, il cui odore caratteristico ci ricorda appunto quello delle verdure tagliate, o dei chetoni dall’odore un po’ meno gradevole, che spesso richiama quello dei grassi un po’ irranciditi.
I due fattori esterni maggiormente incidenti nella generazione di queste molecole, l’ossigeno dell’aria ed i metalli pesanti, possono accentuarsi in modo particolare nella preparazione degli alimenti rispettivamente da un taglio in porzioni particolarmente ridotte del vegetale, eventualmente con superfici frangiate ed irregolari, che accrescono la superficie di contatto fra le cellule e l’aria, e per quanto riguarda i metalli dall’impiego di utensili come coltelli e pentole che rilascino seppur piccole tracce di metalli ferro, cromo o rame.
Nel seguente diagramma sono schematizzati in 3 step i passaggi che portano “già in vivo” alla formazione di tre aldeidi leggere ed intensamente aromatiche che contribuiscono in modo significativo al profumo del pomodoro fresco, a partire dai trigliceridi insaturi di cui è ricca la sua fase lipidica (goccioline oleose che si vedono galleggiare sul succo acquoso di pomodoro appena tagliato).
Al di là dei pochi esempi riportati, le reazioni “extra-Maillard” che possono contribuire alla formazione di molecole organoletticamente rilevanti durante la cottura degli alimenti sono effettivamente un numero piuttosto elevato.
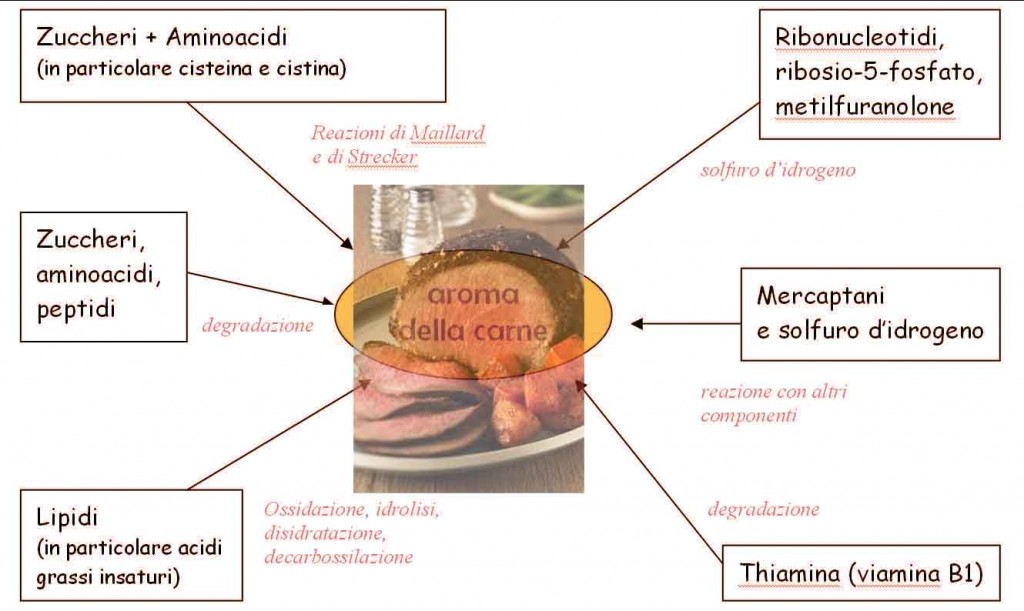
A titolo di esempio nel seguente diagramma sono schematizzati i possibili precursori e le tipologie di trasformazioni che portano alla formazione delle molecole che a vario titolo contribuiscono all’aroma della carne cotta.
Come si vede, le reazioni di Maillard sarebbero solo “uno” dei possibili percorsi, anche se, come vedremo nei prossimi paragrafi, esse racchiudono al loro interno un tale ventaglio di percorsi reattivi ed una diversificazione tale di molecole prodotte che bastano da sole a giustificare la parte preponderante del bouquet aromatico di moltissimi prodotti alimentari cucinati.
LE REAZIONI DI MAILLARD: I PRIMI PASSAGGI
Ma torniamo a bomba sul mondo di molecole che possono generarsi in seguito alle trasformazioni complesse che vanno sotto il nome generico di reazioni di Maillard.
Come anticipato dalla scoperta iniziale del dottor Luise Camille, sono due le classi di molecole che devono essere presenti e, seppur in momenti e con modalità variabili, reagire fra loro: gli zuccheri (meglio detti carboidrati o glucidi) e gli aminoacidi. Ancora più precisamente gli zuccheri devono essere tali da manifestare proprietà riducenti (quindi vanno bene i cosiddetti “esosi” come il glucosio, il mannosio, lo xilosio, il galattosio), mentre i chetosi non contenendo un gruppo funzionale con proprietà riducenti (come ad esempio il fruttosio) risultano un pò meno attivi e danno ragione di un meccanismo e di prodotti di reazione un po’ differenti.
Fra gli aminoacidi una particolare (ma non esclusiva) reattività è stata osservata sui cosiddetti “aminoacidi basici”, ovvero in quelli che oltre al gruppo –NH2 che li caratterizza in quanto aminoacidi, anche un altro gruppo aminico che ne determini una certa basicità caratteristica: sono aminoacidi di questo tipo arginina, asparagina, glutamina, istidina, lisina, prolina.
In fin dei conti quindi pochi tipi diversi di aminoacidi di partenza ed ancora meno carboidrati, a fronte della generazione di bouquet aromatici costituiti da diverse decine, spesso centinaia di molecole differenti.
Ed ora un po’ di chimica organica!
Non spaventatevi se vi sembra di non capire niente: stringete i denti, provate a leggere comunque e vi prometto che alla fine del capitolo avrete compreso molto più di quello che avreste creduto all’inizio. E ricordatevi sempre che la rappresentazione della struttura delle molecole, le cosiddette “formule”, sono un aiuto fondamentale per seguire con gli occhi un discorso che, se fatto solo a parole, allora sì che diventerebbe davvero ingarbugliato!
Se non comprendete una formula di struttura non preoccupatevi eccessivamente: forse in fondo non c’è proprio nulla di recondito da “comprendere” in essa. Le formule di struttura in fondo sono semplici rappresentazioni, come se fossero un ritratto schematico della molecola: osservatele e guardate come esse si trasformano di passaggio in passaggio, in accordo con quanto viene descritto nel testo.
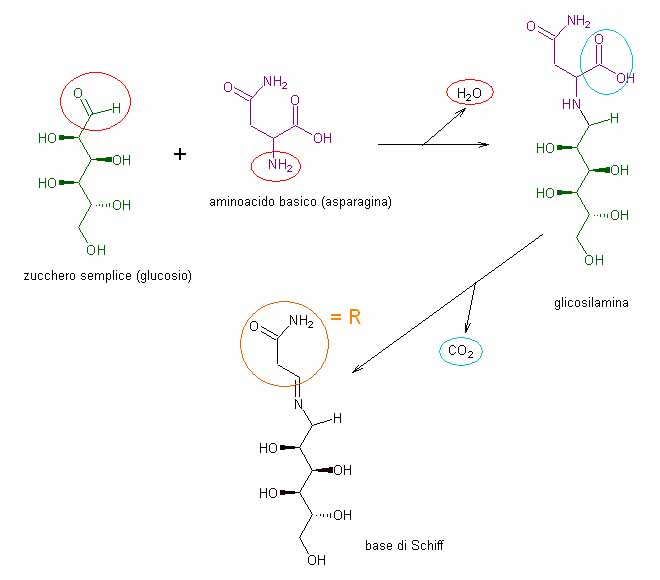
Il primo passaggio, che accomuna tutte le reazioni che prendono il nome da Maillard, prevede la reazione fra il gruppo aldeidico -CHO dello zucchero (l’ossidrile -OH anomerico, quello più attivo se si considera la forma chiusa dello zucchero) ed il gruppo –NH2 alfa-aminico dell’aminoacido, con elimazione di acqua e la formazione di un composto ibrido zucchero-aminoacido, detto glicosamina (ricordare che gli zuccheri sono detti più correttamente gucidi o glicidi).
I non-chimici non diano troppo peso a questi termini di nomenclatura specialistica: nella figura qui sotto ho riportato tutto, perché questo è proprio un chiaro esempio, fra l’altro, di come l’utilizzo delle formule di struttura delle molecole a ‘mo di pittogrammi possa aiutare anche a livello intuitivo la comprensione di un fenomeno chimico molto meglio di tante parole.
Ho anche utilizzato colori differenti, rispettivamente verde e viola, per indicare lo zucchero e l’aminoacido, in modo tale da evidenziare a colpo d’occhio “dove vadano a finire” nella molecola. Parallelamente si vede, tramite una freccia laterale, l’acqua che viene eliminata: è proprio tramite l’eliminazione di questa molecola di acqua che le due porzioni di molecole possono unirsi insieme in una vera e propria sintesi.
Con il cerchio azzurro ho quindi evidenziato sulla struttura della glicosamina quella porzione di molecola che sarà successivamente eliminata, nella reazione successiva, sotto forma di anidride carbonica, CO2.
La nuova molecola che si forma è dal punto di vista chimico definita come una immina secondaria, ma nel linguaggio comune la si indica abitualmente come “base di Schiff”. Notate l’ovale in colore arancione? Esso cerchia una porzione della parte di base di Schiff che deriva dall’aminoacido di partenza e che varia di fatto in relazione al tipo specifico di aminoacido che è stato coinvolto nella reazione, nel caso della figura l’asparagina. Per consentire di fare un discorso generale, valido per tutti gli aminoacidi, oltre che per ragioni di spazio nelle figure, tutta questa porzione variabile della molecola sarà da adesso in avanti sostituita da un gruppo “R”.
Già a questo punto, prima ancora che qualsiasi molecola aromaticamente rilevante si sia formata (sia le glicosamine che le basi di Schiff non sono affatto volatili, quindi non possono contribuire al profumo di un cibo), possiamo però avanzare una considerazione molto importante “per il consumatore”: parte degli aminoacidi inizialmente contenuti nelle materie prime alimentari hanno cessato di essere disponibili. L’asparagina dell’esempio, dal momento che si lega a formare la glicosamina (e questa eventualmente prosegue il suo percorso reattivo) non è più asparagina e non può più essere assorbita e metabolizzata come tale dal nostro organismo. Considerando in particolare i cosiddetti “aminoacidi essenziali”, quelli cioè che l’uomo non è in grado di biosintetizzare con il proprio organismo partendo da altri materiali ma che devono essere necessariamente assunti con la dieta, al pari giusto per intenderci delle vitamine, questo significa un depauperamento parziale delle qualità nutritive dell’alimento. Questi aminoacidi per la precisione sono: fenilalanina, isoleucina, leucina, lisina, metionina, treonina, triptofano e valina, ai quali si aggiungono, almeno nella fase di infanzia e sviluppo: arginina, cisterina, istidina e tirosina.
Come vedremo più avanti, a parte gli aspetti più strettamente organolettici, le reazioni di Maillard che avvengono durante la cottura dei cibi introducono dei beneifici che possono compensare in modo adeguato questo “piccolo” effetto collaterale.
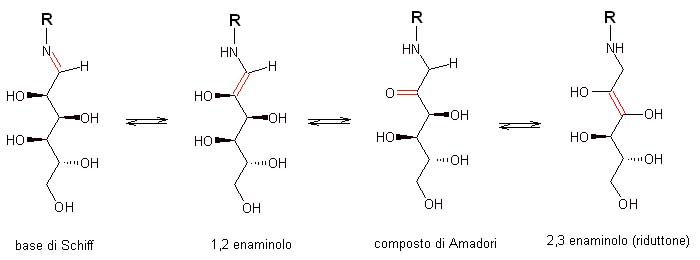
I passaggi successivi sono reazioni di tipo reversibile, come indicato dalle doppie frecce, ovvero che possono procedere in un senso ma anche retrocedere in quello opposto, a seconda dell’ambiente e delle condizioni di trattamento, o meglio ancora possono assestarsi su un equilibrio più o meno ripartito tra le tre diverse specie chimiche riportate in figura: la base di Schiff (che abbiamo visto originarsi dalle reazioni precedenti, queste sì irreversibili), l’1,2-enamminolo, quello che viene definito il “composto di Amadori” ed infine il 2,3-enamminolo (detto anche “riduttone”).
I cambiamenti fra le tre strutture molecolari potrebbero sfuggire ad un’occhiata superficiale: quello che cambia è un doppio legame, che sembra spostarsi da una coppia di atomi all’altro, e che ho quindi colorato di rosso in figura per consentirvi di seguirlo meglio. Nelle tre molecole esso si sposta dalla posizione iniziale sulla coppia azoto N dell’aminoacido-carbonio C dello zucchero, a due atomi di C adiacenti dello zucchero, passando nel composto di Amadori a caratterizzare il legame fra un C dello zucchero e l’ossigeno O ad esso legato, per assestarsi infine nel riduttone sempre fra due diversi C adiacenti ma “più interni” alla molecola, che legano entrambe un –OH.
N.B. Ricordatevi sempre che nelle formule di struttura organiche quando c’è uno spigolo senza riportata nessun simbolo di elemento in modo esplicito, su quello spigolo ci sta un C, ovvero un atomo di carbonio, e la maggior parte degli atomi di idrogeno, quando sono legati direttamente al carbonio, non sono neppure evidenziati come H, anche per non affollare troppo le formule di struttura.
LE REAZIONI DI MAILLARD: L’ORIGINE NEL MICRO-COSMO DEGLI AROMI
Fin qui nulla di terribilmente complicato: abbiamo tre tipi di molecole, quelle in equilibrio nell’ultima figura, che vanno però moltiplicate per il numero di diversi aminoacidi potenzialmente presenti negli ingredienti e per il numero di zuccheri riducenti. Moltiplicando 4 molecole x 20 aminoacidi (quelli che compongono le proteine) per x 6 zuccheri semplici (alcuni fra monoasaccaridi più diffusi: glucosio, ribosio, desossiribosio, xilosio, mannosio, galattosio) arriveremmo già ad un teorico di 480 diverse molecole, ma è ancora presto per sorprendersi.
Nessuna di queste molecole contribuisce ancora alla componente volatile dell’aroma dell’alimento, in quanto si tratta di composti troppo “pesanti” (leggasi: ad elevato peso molecolare) ed anche troppo polari in ragione del gran numero di –OH liberi, derivanti dallo zucchero di partenza ed ancora presenti nella molecola.
Alcune di queste molecole manifestano però importanti valenze funzionali nel contesto dell’alimento: circa i 2,3-enedioli o riduttoni, per esempio, possono essere dette cose parecchio interessanti. Si tratta di una classe di molecole che godono di proprietà fortemente riducenti, e la loro presenza può pertanto costituire una sorta di barriera contro l’ossidazione di altri componenti all’interno dell’alimento. Giusto per citare un esempio, ovviamente estraneo all’argomento Maillard, l’acido ascorbico (vitamina C) ha la struttura di un riduttone e gode delle ben note proprietà antiossidanti. Questo almeno in parte spiega la ragione per la quale in seguito alla cottura molti alimenti risultano più stabili nel tempo, non soltanto dal punto di vista microbiologico ma anche da quello composizionale ed organolettico.
La vera complessità subentra tuttavia solo dal momento che ciascuna delle quattro tipologie di molecole riportate (basi di Schiff, 1,2-enaminoli, composti di Amadori e riduttoni) “si libera” di quel residuo derivante dall’aminoacido di partenza, quello che negli ultimi passaggi avevamo per semplicità identificato in formula come N-R, per semplicità collocato sempre nella parte alta delle strutture molecolari. Il primo elemento di complessità deriva dal fatto che sia il pezzo azotato N-R che si stacca che la parte più grande della molecola che resta sono entrambe a loro modo “interessanti” dal momento che possono generare a loro modo classi diverse di molecole di interesse organolettico.
Come si può vedere in figura, la molecola che si forma dopo l’eliminazione del frammento R-NH2 può isomerizzare in modo reversibile in un’altra molecola, una di quelle ritenute “chiave” per la generazione di intere nuove famiglie di molecole: l’ 1-desossi-2,3-dichetoso.
Per quanto riguarda la parte R-NH2 liberata, essa dipende nella struttura dall’aminoacido che aveva partecipato alla reazione con il carboidrato. Di fatto R-NH2 è sempre un’amina che coincide con la struttura dell’aminoacido di partenza se si elimina da esso il gruppo carbossilico –COOH che come si ricorderà era stato perso nei primi step della reazione sotto forma di CO2.
Nella seguente figura ho riportato quattro esempi di composti di natura aminica liberati rispettivamente da quattro diversi aminoacidi in seguito ai processi finora descritti. Si tratta spesso di molecole molto volatili fortemente maleodoranti, la cui presenza allo stato libero nei cibi dovrebbe essere il più possibile limitata: esempi particolarmente significativi in questo senso sono quello derivante dalla cisteina e dalla lisina, visibili in figura, mentre altre come quella derivante dalla fenilalanina possono avere anche eventuali valenze positive in quanto possono migliorare il nostro stato d’umore e chissà… magari migliorare anche il nostro rapporto con un determinato alimento!
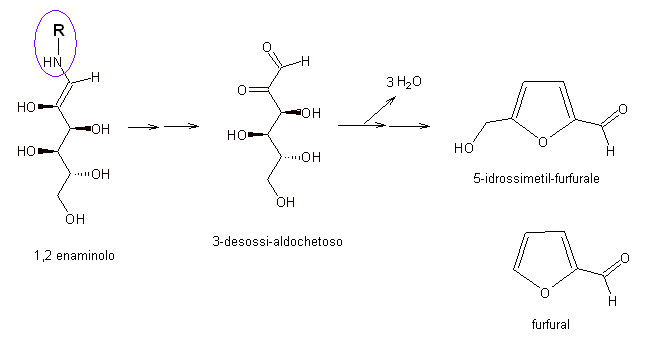
Partendo da un’altra delle 4 molecole in equilibrio fra loro, quella del 1,2-enaminolo, attraverso una serie di passaggi che qui eviterei di descrivere nel dettaglio, si passa comunque dall’eliminazione dell’amina R-NH2 in perfetta analogia a quanto già descritto poco fa per il riduttone; quindi il composto così formato, detto 3-desossi-alochetoso può andare incontro ad una intensa disidratazione, con perdita di ben 3 molecole di acqua. I “pezzi” per comporre queste molecole di acqua sono presi anche da parti distanti della molecola ed è per questa ragione che alla fine del processo di disidratazione la molecola stessa si trova richiusa ad anello, a formare un composto eterociclico ossigenato che avevamo già incontrato nel capitolo precedente dedicato alla formazione di aromi senza il ricordo alle reazioni di Maillard: è la 5-idrossimetil-furfurale, o in alternativa anche la semplice furfurale, in funzione del fatto che lo zucchero di partenza fosse un esoso (a 6 atomi di carbonio, come ad esempio il glucosio) o un pentoso (a 5 atomi di carbonio, come ad esempio lo xilosio). L’odore del furfurale è stato descritto come di mandorla o legnoso.
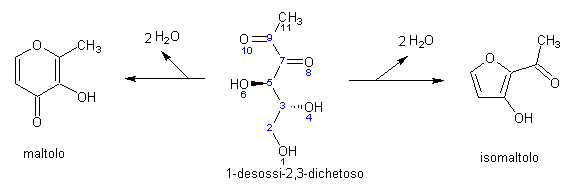
Avevamo tralasciato per un momento la molecola-chiave del 1-desossi-2,3-dichestoso. Questa come si potrà a questo punto intuire può andare incontro ad un ventaglio di destini diversificati: il più semplice probabilmente è quello di chiudersi ad anello con una sorte di reazione testa-coda che comporta l’eliminazione di molecole di acqua. A seconda che gli atomi che vengono a legarsi fra loro siano l’ossigeno 10 ed il carbonio 2 oppure l’ossigeno 8 ed il carbonio 2 (la numerazione è stata introdotta in figura solo per consentire di seguire la dinamica della reazione), si formeranno il maltolo e l’isomaltolo.
Si tratta di molecole dal gradevole profumo, che ricorda quello del cioccolato e del malto.
Un’intera altra classe di molecole organiche, tutte di ridotto peso molecolare (hanno infatti da 2 a 4 atomi di C), ossigenate e volatili, deriva dalla cosiddetta “fissione”, ovvero dalla rottura realizzata secondo modalità ed in un punto variabile, della catena a 5 o atomi di carbonio C derivante dallo zucchero di partenza, ancora chiaramente visibile in tutte e 4 le molecole fra loro in equilibrio.
Piccole molecole organoletticamente rilevanti che possono essere formate in questo modo sono per esempio: piruvaldeide, gliceraldeide, gliossale, acetolo, idrossiacetone, diidrossiacetone, e diacetile (le cui strutture molecolari sono riportate in ordine di enunciazione nella figura qui sotto)
Il punto di partenza può anch’esso costituire una variabile: per quanto si suggerisce che piccole quantità possano formarsi anche direttamente dagli zuccheri di partenza (come il furfurale, seguendo un percorso non-Maillard), si ritiene che la parte preponderante di queste piccole molecole si formino a partire dal composto di Amadori, dal 1,2-enaminolo o dal 1-desossi-2,3-dichestoso (lo stesso che può disidratarsi a maltolto ed isomaltolo). Quando i prodotti di questa reazione si caratterizzano per la presenza di un gruppo aldeidico (simile a quello degli zuccheri di partenza, detti aldoli), questa reazione prende anche il nome di “retro-aldolizzazione”.
Il pH è uno dei fattori “controllabili” (anche da parte del cuoco) che incide maggiormente sull’orientamento delle reazioni di Maillard secondo un determinato decorso preferenziale piuttosto che secondo un altro ad esso alternativo. Il composto di Amadori infatti segue preferenzialmente a pH sufficientemente acidi (<6) la via che porta alla formazione del furfurale ed idrossimetilfurfurale, mentre a pH più tendenti al neutro o al basico (in generale >6) sono favoriti i percorsi di formazione dei riduttoni e dei già descritti prodotti di fissione, fino a spingersi (a temperatura sufficientemente elevata) alla formazione dei noti composti eterociclici così importanti per descrivere la composizione di moltissimi aromi di cottura.
I COMPOSTI ETEROCICLICI DALLE REAZIONI DI MAILLARD
Inutile però girare ancora intorno a quello che per certi versi considero “il cuore” dell’aroma, nel senso del raggruppamento al tempo stesso più folto e in moltissimi casi maggiormente rilevante sul piano organolettico: quello dei composti eterociclici. Ho già avuto modo di descrivere questa macro-categoria di molecole organiche nell’ultimo articolo sull’argomento, senza tuttavia spendere una parola circa i loro meccanismi di formazione nell’ambito delle reazioni di Maillard. Ora sulla base delle conoscenze acquisite avremo modo di descrivere l’origine di almeno un paio di queste, anche se come si ricorderà dall’articolo precedente le classi di composti eterociclici che entrano a far parte dell’aroma dei cibi sono un certo numero, e in questo intervento non potremo di certo esaminarle tutte.
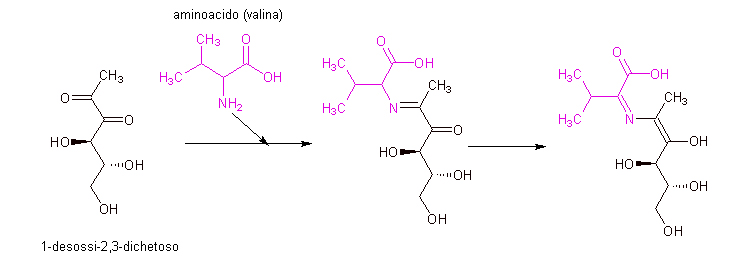
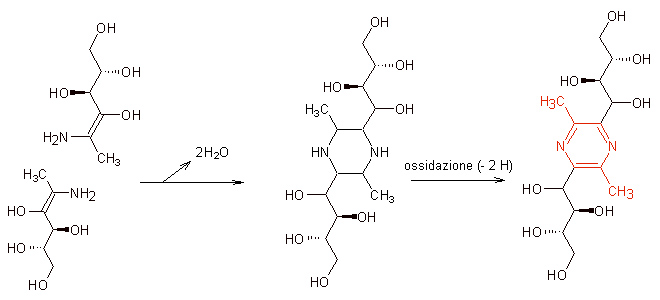
Il discorso riprende dall’ultima molecola-chiave descritta, il 1-desossi-2,3-dichetoso. Ricordate? Quella che si era formata per perdita di un residuo di aminoacido. Ecco, non credo che il difetto di essere “indecise” si possa applicare anche alle molecole, ma se me lo consentissero non esiterei a definire indeciso questa molecola di origine zuccherina: appena due passaggi dopo avere rinunciato alla sua parte di aminoacido, ed aver quindi perso anche lo stesso azoto N aminoacidico che se n’è andato insieme al frammento R-NH2 come descritto nel capitolo precedente, ecco che ora il 1-desossi-2,3-dichestoso torna a legarsi con un nuovo aminoacido, come mostrato in figura.
Si tratta di una reazione di condensazione, molto simile a quella calla quale era partito tutto il carosello di Maillard, quella di formazione della glicosilamina e da questa la base di Schiff. Di fatto quello che va a formarsi ora è molto simile ad una base di Schiff, con la differenza però che ora la molecola contiene, subito sotto il C che lega il nuovo aminoacido, un gruppo che tonico C=O. Sembrano inezie, ma come si vedrà sono sufficienti a far andare il processo di reazione completamente da un’altra parte rispetto a cos’era accaduto nei primi step del processo di Maillard. Ancora una volta ho evidenziato con un colore diverso nelle strutture molecolari la parte che deriva dall’aminoacido (in questo caso abbiamo preso come esempio la valina).
Proprio com’era avvenuto con la glicosamina, anche in questo caso la molecola va incontro ad un riarrangiamento, che comporta lo spostamento di legami fino alla formazione della struttura più a destra, estremamente simile alle già descritte basi di Schiff.
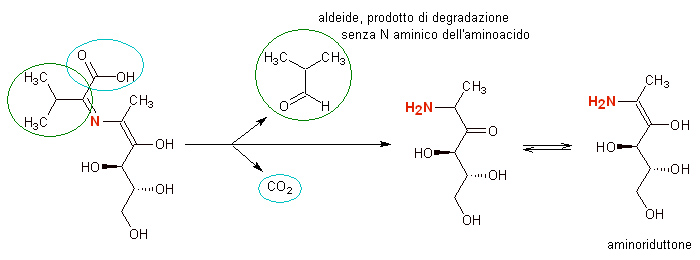
A questo punto può avvenire una delle reazioni più importanti dell’intero processo, una reazione nota con il nome di “degradazione di Strecker”, che nel contesto delle preparazioni alimentari ricorre tipicamente a temperature elevate
qui come si può vedere dalla figura sono eliminati contemporaneamente due frammenti: uno (cerchiato in azzurro) riguarda il gruppo carbossilico –COOH della parte della molecola che derivava dall’aminoacido, che viene perso sotto forma di anidride carbonica CO2. L’altra eliminazione, ben più importante, è relativa ad un secondo frammento sempre del residuo di aminoacido: quello che si libera è essenzialmente quello che resta dell’aminoacido di partenza al netto del gruppo carbossilico –COOH e del gruppo amminico –NH2, che viene invece lasciato sulla parte “zuccherina” della molecola.
Nel punto di rottura del residuo di aminoacido si forma un gruppo aldeidico –CHO che attribuisce alla molecola una notevole reattività. Di fatto quella che si forma è un’aldeide simile all’aminoacido di partenza, ma con un carbonio C in meno e senza il gruppo amminico. Da qui si intuisce la ragione del nome “degradazione” di Strecker.
Queste aldeidi sono volatili e dotate di un proprio odore caratteristico, che assume caratteristiche particolarmente significative quando l’aminoacido di partenza è di tipo solforato, ma possono anche partecipare a nuove vie di reazione per la formazione di ulteriori molecole.
La parte più grossa della molecola, come si può vedere in figura, trattiene il gruppo amminico –NH2 (in colore rosso) e può convertirsi in una forma amminica dei già descritti “riduttori”, detta appunto aminoriduttone.
L’aminoriduttone, come il suo analogo riduttone, è una tipologia di molecola molto reattiva nei confronti di altre molecole. Due molecole di aminoriduttone, in particolare, possono reagire fra loro, come ho illustrato in questa figura. Ho dovuto capovolgere una molecola e girarne speculaarmente un’altra, ma questo solo per consentirvi a livello visivo di poter intuire meglio come sia possibile che due di queste molecole si accoppino nel modo descritto.
Effettivamente quella che si realizza è come una doppia reazione di consesazione, dove ogni gruppo amminico –NH2 si lega ad carbonio enolico: questo fa sì che, con l’eliminazione di due molecole di acqua, si crei un anello chiuso contenente al suo interno due atomi di azoto.
Ecco così formato uno dei famigerati composti eterociclici, già descritti nell’articolo rpecedente, che così tanto incidono nelle qualità aromatiche dei cibi cotti sia in funzione della loro elevata percepibilità olfattiva anche a bassissime concentrazioni che in funzione delle tipologie di odori che esse rappresentano. Con un successivo step di reazione di tipo ossidativo la molecola perde quei due idrogeni H che le consentiranno di assumere la forma tipica di una pirazina. Step di reazioni successivi potranno portare all’eventuale perdita dei due residui di zuccheri ancora legati a questa molecola e la liberazione della parte che ho colorato in rosso, che corrisponde alla 2,5-dimetilpirazina, una molecola che ha un odore che a seconda delle concentrazioni e dei valutatori è stato descritto come di nocciolina, di carne o addirittura di legno.
PROSPETTIVE
Dall’esame di tutte le tipologie di reazioni finora esposte, ben lungi dal completare l’argomento, si osserva l’influenza più o meno esplicita di almeno 5 differenti fattori:
1) composizione degli ingredienti
2) temperatura
3) pH
4) umidità
5) azione di massa sui componenti rilasciati
E’ logico intuire che siano proprio questi i fattori sui quali il cuoco molecolare dovrebbe intervenire nel caso volesse pilotare l’andamento delle reazioni in una o più direzioni preferenziali, oppure inibire un certo decorso indesiderato con la formazione ad esempio di molecole aromatiche indesiderate.
La conoscenza ed il controllo, nei limiti delle tecniche e dei mezzi disponibili in cucina, di questi importanti fattori, fino ad una sorta di possibile “ingegnerizzazione del sapore” sarà oggetto di un successivo intervento.
TESTI SUGGERITI PER I CHIMICI
La letteratura scientifica italiana, ivi compresa quella straniera tradotta nella nostra lingua, non comprende ancora titoli significativi, in termini di sistematicità di approccio e di livello di approfondimento, dedicati specificamente all’argomento delle reazioni di Maillard.
Per quanti fossero interessati ad approfondire l’argomento in lingua inglese, ho selezionato 4 testi fra quelli che io stesso ho consultato anche durante l’estensione di questo intervento.
1) Un testo compatto, non eccessivamente complesso che contiene una introduzione a mio parere molto esplicativa sull’argomento delle reazioni di Maillard, con approfondimenti relativi alle implicazioni biochimiche e biomediche di queste molecole ed alla loro interazione con i radicali liberi. Particolarmente consigliato:
The Maillard Reaction – Consequences for the Chemical and Life Sciences – edited by R. Ikan – Hebrew University of Jerusalem, Israel – 1996 – John Wiley & Sons – ISBN 0-471-96300-3
2) Un testo per certi versi trasversale, che descrive la formazione e le caratteristiche dei composti cosiddetti “eterociclici” (composti organici contenenti uno o più atomi fra ossigeno, azoto, zolfo, ecc, chiusi in una struttura ad mono- o policiclica, ovvero anello/i) nella trasformazione dei materiali biologici ed in particolare alimentari, indipendentemente dal fatto che questi si formino per reazioni di Maillard oppure attraverso altre tipologie di reazioni:
Chemistry of heterocyclic compounds in flavours and aromas – G. Vernin – 1982 – Ellis Horwood Limited – ISBN 0-85312-263-6
3) Un testo particolarmente dettagliato, tenuto conto della sua estensione limitata, che fornisce una visione globale delle vie di formazione delle principali classi e singole molecole attraverso le reazioni di Maillard ed affronta in seguito, sia in modo teorico che sperimentale, l’influenza esercitata dai diversi fattori chimici e fisici implicati. Particolarmente consigliato:
The Maillard reaction: chemistry, biochemistry, and implication – H. E. Nurtsen – Royal Society of Chemistry (UK) – 2005 – ISBN 978-0-85404-964-6
4) Un testo breve (solo 120 pagine) che offre una visione generale anche se non particolarmente approfondita dell’argomento, relativamente al contesto alimentare: dalle reazioni di formazione alle simulazioni con modelli sperimentali, dall’effetto sull’aroma a quello sull’imbrunimento dei prodotti, con particolare approfondimento alle tecniche per l’estrazione e l’analisi delle molecole prodotte dalle reazioni di Maillard.
The Maillard Reaction – S. E. Fayle; J. A. Gerrard – editor Peter S. Belton – The Royal Society of Chemistry (UK) – 2002 – ISBN 0-85404-581-3