Creare la plastica è un po’ come giocare con il Lego, con la differenza che i mattoncini non li puoi vedere e quindi devi organizzarti molto bene fin dall’inizio per fare in modo che una volta agitati tutti insieme nella scatola si combinino nel modo che volevamo.
Innanzitutto dobbiamo scegliere i mattoncini, che nel nostro caso sono le molecole: possiamo puntare su mattoncini tutti uguali, per realizzare una costruzione uniforme e regolare che si definisce un “omo-polimero” (es. il polietilene, il positirolo, ecc), oppure su mattoncini diversi, anche solo di due tipi, puntando alla realizzazione di un “co-polimero” (es. la bachelite).
Solitamente i mattoncini utilizzati dal chimico, i cosiddetti “monomeri” (che tradotto significa “una parte”) sono delle sostanze alquanto problematiche: il fatto stesso che riescano così bene ad organizzarsi fra loro, legandosi tramite una reazione complessa detta appunto “di polimerizzazione”, le rende molto reattive, ed il fatto che una sostanza chimica sia molto reattiva non è mai un beneficio per la salute di chi la vuole utilizzare. Questi monomeri allo stato libero sono solitamente liquidi, a volte addirittura gassosi e solo con la polimerizzazione formano una struttura più grande, complessa, liquida o più spesso solida, quella che tutti noi chiamiamo plastica ma che, nel ricordo del polimero dal quale eravamo partiti, potremo chiamare anche polimero.
Esistono reazioni di polimerizzazione che procedono spontaneamente e molto velocemente, così velocemente che possono sfuggire di mano e rappresentare un rischio potenziale per l’integrità degli impianti e degli operatori. Si pensi ad un serbatoio dove è contenuto un liquido che improvvisamente si solidifica aumentando di volume e magari di temperatura: minimo minimo il serbatorio si spacca! Ecco perché sulle schede di sicurezza delle sostanze chimiche, insieme alle altre indicazioni di perciolo si menziona di solito il fatto che una sostanza possa o non possa essere soggetta a reazioni di polimerizzazione pericolose.
Sul versante opposto vi sono quei monomeri che devono essere incoraggiati, stimolati, di solito per riscaldamento o meglio ancora con l’aggioutna di minuscole quantità di un acido o di una base, altri ancora con quello che si definisce un iniziatore radicalico.
Nel caso della bachelite basta aggiungere un po’ di acido o anche una base (come si vedrà si ottengono risultati diversi) e riscaldare un po’.
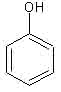
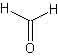
Sempre in questo caso, i monomeri utilizzati sono di due tipi diversi: uno è il fenolo, l’altro è la formaldeide.
In qualche modo potremmo vederli rispettivamente come il mattone ed il cemento che vanno a costruire la struttura tridimensionale della bachelite.
Il fenolo, detto anche acido fenico, è un liquido sciropposo e tossico, dal caratteristico odore… di fenolo. La formaldeide sarebbe in realtà un gas, ma quasi tutti la conoscono nella sua forma sciolta in acqua, chiamata anche formalina, la stessa utilizzata per conservare i campioni biologici per lungo tempo, ad esempio negli istituti di anatomia; anche noi in questa sede la useremo in forma di soluzione acquosa.
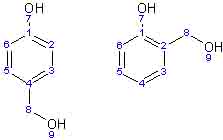
Ecco, se noi mettiamo insieme fenolo e formaldeide sciolta in acqua, aggiungiamo una minima quantità di idrossido di sodio (la soda caustica), nel corso dei giorni accade che la formaldeide a livello microscopico “si fissa” sul fenolo, e precisamente lo fa sotto forma del gruppetto che compare nelle posizioni 2 o 4 nelle due posizioni che adesso vi mostro
Questa reazione è stata scoperta e pubblicata nel 1884 in contemporanea da due ricercatori che lavoravano sullo stesso argomento: il tedesco Otto Manasse e l’americano Julius Lederer, anche se solo quest’ultimo riuscì a sfruttare la scoperta per applicazioni industriali.
Ma quello che ho appena descritto è soltanto l’inizio: le due molecoline che si sono formate dopo circa 6 giorni di riposo sono pur sempre dei monomeri, per quanto un po’ più attivi, e devono ancora essere organizzati fra loro per costituire la bachelite. Per proseguire la metafora, sono come mattoncini ben intinti nel cemento, quindi perfettamente pronti ad attaccarsi insieme.
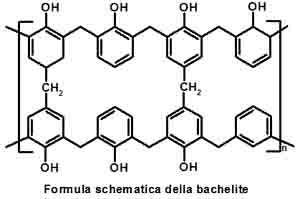
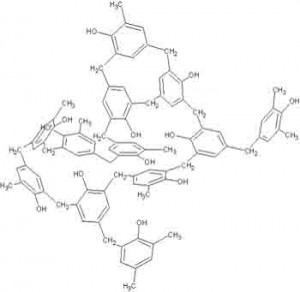
Il passaggio successivo infatti richiede un’aggiunta di ulteriore fenolo ed un breve riscaldamento: ecco che allora si perderà dell’acqua e le due molecole di prima si organizzeranno fra loro secondo non soltanto formando catene ma complessi reticoli bidimensionali
Da qui ad ottenere una bachelite su larga scala secondo un metodo di produzione riproducibile ed economicamente conveniente sarà ancora questione di qualche anno, precisamente fino al 1909 quando l’americano di origine belga Leo Hendrik Baekeland (da cui il nome di bakelite) verifica che quella massa spesso appiccicosa ed eccessivamente “plastica” che si ottiene dalla fase di riscaldamento può essere indurita notevolmente ottimizzando la fase di raffreddamento, ma soprattutto si può giocare molto sull’aggiunta di altri ingredienti a basso costo, come ad esempio segatura ed asbesto, cotone, o magari coloranti. Restava la difficoltà di mantenere una buona qualità del prodotto a causa della schiuma che si formava nel corso della preparazione, schiuma che spesso si traduceva in bolle poi anche dentro i pezzi finiti. Risolto questo problema con una sorta di pentolone a pressione, Baekland brevettà nel 1906 la produzione della bachelite così come oggi la intendiamo.
Nella preparazione di un co polimero come la bachelite si può giocare abbastanza liberamente su una serie di fattori per modificare in parte il risultato finale.
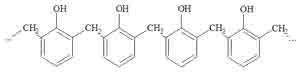
Lavorando con un eccesso di fenolo rispetto alla formaldeide ed utilizzando un acidula posto della soda come catalizzatore si ottiene una variante detta Novolacca, una catena lunga e lineare che conferisce al prodotto caratteristiche di particolare termoplasticità tanto da poter essere rimodellata anche più volte per riscaldamento.
La struttura bidimensionale schematizzata due immagini prima invece è ottenuta lavorando con un eccesso di formaldeide rispetto al fenolo: la resina che si ottiene prende il nome commerciale di Resolo ed è, al contrario della novolacca, caratterizzata da proprietà termoindurenti. Per lavorarla si è quindi soliti pressarla mediante stampi a caldo.
Con il passare del tempo sono stati tentati, con alterno successo, anche tutta una serie di variazioni sul tema della bachelite che partivano non tanto dalla modifica del processo di produzione, quanto dagli stessi ingredienti.
Il fenolo ad esempio può essere sostituito totalmente o in parte da una miscela di cresoli
ed allo stesso modo la formaldeide può essere sostituita totalmente o in parte con acetaldeide o con furfurale.
Se riuscissimo a vedere veramente a livello microscopico la struttura della bachelite, soprattutto quella di quest’ultimo tipo, molto reticolata, ci accorgeremo che la realtà non è piatta, ma perfettamente tridimensionale, tanto da rendere difficoltosa la sua rappresentazione su un semplice foglio di carta:
Il test empirico che talvolta si utilizza per confermare il fatto che un vecchio oggetto, magari candidato alla categoria del vintage nelle nostro collezioni, sia realizzato in bachelite piuttosto che in una plastica più moderna, più resistente e forse anche più economica ma sicuramente meno gloriosamente storica, consiste nel riscaldare lievemente il pezzo, idealmente anche solo per contatto con acqua calda: nel caso della bachelite riconosceremo facilmente lo sviluppo dell’odore caratteristico del fenolo.
La bachelite quindi è stata la prima plastica prodotta sinteticamente nella storia dell’uomo e, per molti versi, il primo polimero sintetico in generale.
In natura esistono in vertià molti polimeri e molti di essi rivestono fondamentali funzioni biologiche: sono polimeri l’amido e la cellulosa (entrambe hanno come monomero il glucosio, seppur organizzato in modo diverso), lo sono il glicogeno che costituisce la riserva di glucosio interna dell’organismo umano, lo è la chitina che a sua volta costituisce il materiale costitutivo sia dei funghi che dell’esoscheletro degli insetti. Tutte sostanze perfettamente biodegradabili, dal momento che i batteri ed i funghi diffusi in natura e preposti alla decomposizione dei residui organici hanno avuto parecchi milioni di anni per evolversi in funzione della produzione di enzimi specificamente adatti a “de-polimerizzare” questo genere di sostanze. In alcuni casi, come quello dell’amido, il legame fra un monomero e l’altro è talmente labile che potrebbe col tempo essere scisso semplicemente dalla presenza di acqua e da quel po’ di acidità che in realtà si trova un po’ ovunque, ad iniziare dal nostro stomaco. Ma per i polimeri sintetici “inventati” dall’uomo è diverso, e la diversità deve essere fatta risalire non soltanto nel fatto che fino all’altro ieri (inteso dal punto di vista dell’evoluzione del pianeta) non c’erano, ma anche dal fatto che ogni buon produttore farà il possibile per rendere la sua plastica quanto più resistente possibile, puntando su fitti reticoli e su legami assai tenaci.
Una soluzione? A parte puntare su polimeri plastici maggiormente più biodegradabili, magari “a scadenza temporale”, potrebbe puntare in una direzione maggiormente etica inventare, insieme ad ogni nuova sostanza ingombrante anche il microrganismo al quale abbiamo insegnato a smontarla.