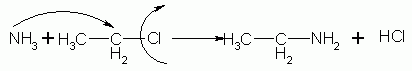Indice
Le ammine sono molecole riconducibili all’ammoniaca (NH3) in quanto possiedono un atomo di azoto mono-, di- e trisostituito con gruppi alchilici ed arilici. Una caratteristica chiave delle amine è dovuta alla loro basicità rappresentativa del fatto che l’azoto possiede un doppietto elettronico libero. Oltre ad essere delle basi le ammine sono una classe di molecole dal carattere nucleofilo e, per questo motivo, possono attaccare altre molecole elettrofile formando una serie di interessanti reazioni sia dal punto di vista della chimica organica che dal punto di vista delle biochimica.
La nomenclatura delle amine.
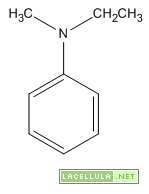
Le ammine possono essere distinte in alchilammine o arilammine in base al tipo di sostituente legato all’azoto. Le alchilammine hanno sostituenti non aromatici (metilammina, dietilammina) mentre le arilammine hanno uno o più anelli aromatici legati all’atomo di azoto (anilina, n-metilanilina). Inoltre le ammine possono essere distinte in:
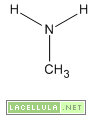
-Ammine primarie quando possiedono un solo sostituente come nel caso della metilammina o della etilammina.
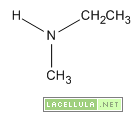
-Ammine secondarie quando possiedono due sostituenti come nel caso della dimetilammina o della dietilammina.
-Ammine terziarie quando hanno tutti e tre gli atomi di idrogeno sostituiti, come nella trimetilammina o nella trietilammina.
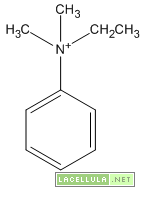
-Ammine quaternarie quando tutti e tre gli idrogeni sono sostituiti ed, in aggiunta, l’atomo di azoto per mezzo del proprio doppietto libero lega a sé una ulteriore catena carboniosa.
Rispetto all’ammoniaca le ammine sono molecole più basiche. Per arrivare a questa considerazione basta considerare il pKb dell’ammoniaca e quello delle rispettive ammine di riferimento tenendo in considerazione il fatto che maggiore è il valore del pKb minore è la forza della base. Le ammine aromatiche, inoltre, hanno un livello di basicità milioni di volte inferiore rispetto all’ammoniaca. Per comprendere quella che viene definita scala di basicità delle ammine è necessario tenere in considerazione alcuni aspetti
I gruppi sostituenti non hanno la stessa tendenza ad attrarre o donare gli elettroni. I gruppi elettrondonatori, come le catene carboniose, tendono a “spingere” gli elettroni verso l’azoto che pertanto è più facilitato a condividere il proprio doppietto elettronico. Evidentemente più lunga è la catena carboniosa legata all’azoto maggiore è la basicità di quest’ultimo e questo spiega perché la metilammina è meno basica della etilammina. Viceversa i gruppi elettronattrattori tendono ad “appropriarsi” del doppietto presente sull’azoto e, per questo motivo, diminuiscono la sua basicità.
Il solvente, a sua volta, può accentuare o meno la basicità delle ammine. Se il solvente è anche lievemente polare, come lo è l’acqua, è possibile la formazione di complessi sia con gli idrogeni ancora legati all’azoto, sia con l’azoto stesso.
| Molecola | pKb |
| Ammoniaca | 4.76 |
| Metilammina (primaria) | 3.36 |
| Etilammina (primaria) | 3.19 |
| Dimetilammina (secondaria) | 3.27 |
| Dietilammina (secondaria) | 3.02 |
| Anilina (aromatica) | 9.37 |
| 4-nitroanilina (aromatica) | 13.0 |
In ultima analisi si deve considerare l’ingrombro sterico. Questo, in parte, può inficiare il punto 1 perché se è vero che le catene carboniose sono discrete elettron-donatrici è anche vero che una ammina trisostituita, magari da sequenze lunghe di atomi di carbonio, può rappresentare un elemento di ingrombro sterico che impedisce l’attacco all’azoto da parte dell’acido coniugato.
Sintesi delle ammine mediante ammoniaca ed alogenuri alchilici
La reazione è una sostituzione nucleofila di secondo ordine (SN2) perchè l’attacco dell’ammoniaca è parallelo all’uscita dell’alogeno. Data la scala di basicità delle ammine, però, si deduce che la reazione può risultare problematica qualora ci sia un eccesso, o anche una equivalenza, di alogenuro alchilico. Un’ammina monosostituita da una catena alchilica è, infatti, più basica dell’ammoniaca e compete con essa nell’attacco nucleofilo. Se si desidera sintetizzare ammine polisostituite, fino all’ammina quaternaria, è necessario agire in equivalenza dei reagenti altrimenti, se si vuole fermare la reazione con una sola sostituzione, si può immettere nel reattore una quantità maggiore di ammoniaca.
Reazione di ammoniaca con cloruro di etile.
Il cloruro di etile è un alogenuro alchilico formato da una catena carboniosa di due atomi con ibridizzazione sp3 con annesso un cloro. A contatto con l’ammoniaca avviene una reazione di sostituzione nucleofila che genera un’ammina primaria, l’etilammina, ed una molecola di acido cloridrico secondo la seguente reazione:
La reazione però non si ferma in quanto l’etilammina è una molecola ancora più nucleofila dell’ammoniaca e compete con essa per agganciare una molecola di alcano. Per questo motivo si assiste alla reazione che sintetizza la dietilammina
E così via fino ad arrivare ad una ammina tetralchil sostituita. Come è già stato detto operando in eccesso di ammoniaca sarà presente quasi esclusivamente il prodotto di monosostituzione (etilammina) altrimenti si otterranno i prodotti di polisostituzione.