Indice
Le analisi volumetriche o, titolazioni, sono dei procedimenti di natura quantitativa grazie ai quali è possibile determinare la concentrazione di un analita valutando il volume di un reagente (a concentrazione nota) utilizzato in una reazione tra l’analita ed il reagente. Risulta essere importante conoscere con esattezza la concentrazione del reagente poiché questo valore serve per ricavare la concentrazione dell’elemento da titolare.
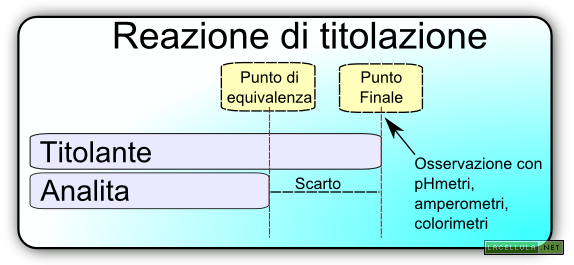
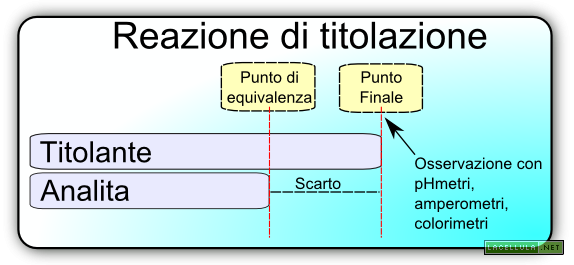
Qual’è il principio cardine dell’analisi volumetrica? In questa metodica si cerca di stabilire il punto di equivalenza tra un reagente (o titolante a concentrazione nota) e l’analita. In altre parole si valuta quanto titolante è necessario per reagire completamente con l’analita fino ad arrivare al cosiddetto punto di equivalenza.
Il punto di equivalenza è una posizione teorica e la cui dimensione è soltanto ipotizzabile nella quale il numero di equivalenti di titolante è uguale al numero di equivalenti della molecola da analizzare. In altri termini:
Vt∙ Nt = Va ∙ Na
Dove
V = Volume
N = Numero di moli
In una analisi pratica, tuttavia, ciò che l’operatore rileva è il punto finale mediante l’utilizzo di un indicatore o di uno strumento capace di percepire una variazione di stato del sistema in soluzione. In altre parole l’analisi, di per sé, introduce un errore poiché per i limiti dell’esperimento stesso non è mai possibile arrivare al punto di equivalenza ma si cerca di arrivare quanto più possibile vicino ad esso.
Standard primari e secondari
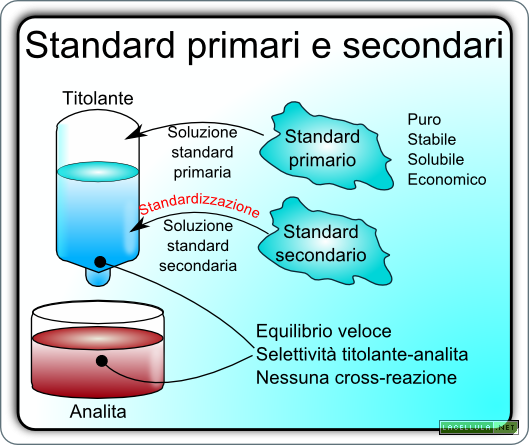
Se l’agente titolante soddisfa i requisiti dello standard primario questo può essere direttamente utilizzato per preparare la soluzione standard primaria. Quali sono questi requisiti?
-Deve essere puro. La presenza di impurità potrebbe falsare l’analisi in quanto queste molecole potrebbero a loro volta reagire con il titolante, con una molecola della soluzione titolante o con una molecola della soluzione da analizzare.
-Deve essere stabile. Per quanto possibile non si deve ossidare o ridurre e non deve reagire con l’aria assorbendo o cedendo ossigeno oppure anidride carbonica.
-Non deve cross-reagire con altri elementi del sistema.
-Deve essere solubile.
-Deve essere economico.
Anche la soluzione standard deve avere alcune caratteristiche:
-Deve essere stabile.
-L’equilibrio tra analita ed agente di titolazione deve essere molto veloce. È chiaro che se la reazione fosse estremamente lenta i risultati, di conseguenza, sarebbero disponibili in tempi irragionevoli.
La soluzione standard primaria garantisce un’accurata analisi ma spesso non è semplice trovare uno standard primario da utilizzare per la sua preparazione. La maggiore difficoltà applicativa risiede nel fatto che la molecola da utilizzare presenta impurità difficilmente eliminabili oppure tende a reagire con altri elementi del sistema. In questo caso, ovvero quando l’agente di titolazione non rispetta gli standard, si parla di standard secondario che attraverso alcuni processi, perlopiù di determinazione della concentrazione, forma la cosiddetta soluzione standard secondaria. È chiaro che l’utilizzo di quest’ultima conduce ad una analisi più grezza e meno precisa.
Titolazioni acido base
Da questa espressione è possibile ricavare la Ka
La precedente equazione si può esprimere in termini di concentrazione idrogenionica [H3O+] e diventa
Abbiamo detto che l’indicatore acido o basico cambia colore in base al pH della soluzione. Questo cambiamento viene apprezzato quando il rapporto tra la componente indissociata (HIn) e dissociata (In–) è pari a 10 ed 1 rispettivamente per pH acidi o basici. A questo punto è opportuno ricordare che le specie che si dissociano hanno un pK caratteristico ovvero un punto di pH nel quale si ha una equimolarità tra forma indissociata e forma associata. Il rosso fenolo, che è un colorante leggermente basico, ha un pK di circa 7.8 per cui a questo valore di pH data una mole di molecole si avrà mezza mole in forma indissociata e mezza mole in forma dissociata.
Titolazione acido forte – base forte
L’acido cloridrico (HCl) è un acido forte perché se disciolto in acqua si dissocia totalmente in protoni e anioni cloro
Allo stesso modo si definisce base forte una molecola che in acqua si dissocia totalmente. L’idrossido di sodio è un esempio
La titolazione di un acido forte si mette in pratica utilizzando una base forte che serve da agente titolante. Aggiungendo un certo quantitativo di base e monitorando l’indicatore la soluzione vira da acida a neutra. In altre parole il pH si sposta da <7 a 7 che rappresenta il punto di neutralità. Un quantitativo di base pari al quantitativo disciolto di acido serve per portare alla neutralità la soluzione e conoscendo il quantitativo di base aggiunta è facilmente calcolabile la concentrazione dell’acido inizialmente presente.
Supponiamo di avere in una soluzione di 50mL acido cloridrico e che la concentrazione sia pari a 0.01; il pH della soluzione è, di conseguenza, pari a 2. Quanta base deve essere aggiunta per portare il pH a 7? Esattamente 50mL se la base ha un concentrazione pari a 0.01M. Alla neutralità è possibile utilizzare l’indicatore rosso fenolo che ha un pK di circa 7.4; con questa molecola quando la soluzione è acida il colore dell’indicatore tende al giallo mentre al raggiungimento del punto di equivalenza si apprezza una variazione di colore e la soluzione tende al rosso.
L’analista, nella maggior parte dei casi, ha il compito di stabilire la concentrazione del titolato conoscendo soltanto il volume iniziale della soluzione, il volume di titolante aggiunto e la concentrazione del titolante. Per ricavare la concentrazione dell’analita si usa la relazione:
V(titolato) * M(titolato) = V(titolante) * M(titolante)
che diventa
M(titolato) = V(titolante) * M(titolante) / V(titolato)
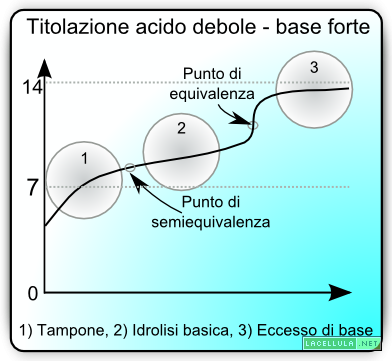
Titolazione acido debole – base forte
La titolazione in questione è leggermente differente dalla titolazione acido forte – base forte che abbiamo visto precedentemente in quanto si raggiungono differenti punti durante l’esperimento. Un’altra differenza è data dal fatto che il pH del punto di equivalenza, in una titolazione dove una delle due specie è debole, non necessariamente è pari a 7.
All’inizio non c’è titolante, ovvero NaOH, per cui il pH è derivabile dalla concentrazione dell’acido debole. In questo caso
Risulta essere da ricordare che nel caso degli acidi deboli non si usa la formula pH = -log([acido]) poiché si deve tener conto che non tutto l’acido è dissociato.
Diciamo adesso che l’aggiunta della base forte può proseguire fino al raggiungimento del punto di equivalenza; anticipiamo che non bisogna confondere il punto di equivalenza di un sistema acido forte – base forte con il punto di equivalenza di un sistema con un elemento, acido o base che sia debole. Cosa succede quando si aggiunge al sistema una goccia di titolante? La reazione è la seguente
Si forma acetato di sodio ed acqua. L’acetato di sodio è il sale di un acido debole ed una base forte per cui, in soluzione acquosa, da una idrolisi basica. Per calcolare il pH si può utilizzare l’equazione di Handerson-Hasselback
Come si stabiliscono, di volta in volta, le concentrazioni? L’analisi in questione è di tipo quantitativo nel senso che bisogna, di volta in volta, calcolare le moli di acido debole / base forte rimaste (o consumate) e le moli del sale e dell’acqua formate. Per esempio
(mmol) | CH3COOH | NaOH | CH3COONA | H2O |
| Inizio | 10 | 5 | // | // |
| Consumate | 10-5 | |||
| Fine | 5 | 0 | 5 | 5 |
L’effetto tampone si attenua non appena si raggiunge il punto di equivalenza. È importante comprendere che il punto di equivalenza nella titolazione acido debole – base forte non è necessariamente pari a pH 7. A livello del punto di equivalenza si apprezza una idrolisi basica derivante dal sale formatosi. Subito dopo l’equivalenza la base aggiunta prende il “controllo” della situazione e l’eccesso che si viene a trovare in soluzione determina attivamente il pH.