Indice
I metodi gravimetrici sono rappresentati dai protocolli analitici che portano all’analisi quantitativa e qualitativa di una sostanza in un campione mediante il fenomeno della precipitazione di questa coadiuvata da un agente di precipitazione. Il discorso potrebbe sembrare semplice ma, in realtà, coniuga molte tecniche di lavoro ed è spiegato da diversi fenomeni fisico-chimici che, nel complesso, portano alla precipitazione dell’analita in questione. Dobbiamo ricordare che non esiste un analita standard proprio come non esiste un singolo agente di precipitazione; in base al tipo di ricerca si possono utilizzare differenti analiti e differenti metodi di lavoro. I principali tipi di analisi gravimetrica sono due: precipitazione e volatilizzazione. Nella precipitazione un elemento incognito, spesso in quantità anziché in tipo, viene mescolato in una soluzione con un agente di precipitazione specifico che si lega ad esso. Nella volatilizzazione un soluzione contenente l’analita viene riscaldata per permettere la vaporizzazione del complesso soluzione-analita.
Precipitazione
L’agente di precipitazione deve avere alcune, fondamentali, caratteristiche:
-Deve essere quanto più specifico possibile; un agente di precipitazione che si lega a più analiti falsa i risultati.
-Deve formare un complesso che presenta una minima solubilizzazione.
-Deve agire velocemente.
-Deve essere quanto più inerte possibile rispetto alle condizioni di analisi (umidità, calore)
Il passo successivo alla volatilizzazione o alla precipitazione è quello di filtrare l’analita e allontanare da esso le impurità mediante lavaggi con soluzioni o solventi. In linea generale viene lasciato il tutto a riposo per operare la fase della digestione; in questo periodo l’analita precipitato acquisisce un maggiore grado di purezza. Per filtrare l’analita si utilizza la carta, la ceramica od il crogiolo di Gooch.
Precipitazione dei colloidi
In linea generale l’equazione che riassume le variabili che modificano la precipitazione è data dal calcolo della supersaturazione relativa che è pari a:
Sr = (Q- S) / S
dove Q è la concentrazione dell’analita in un determinato istante mentre S è la sua solubilità all’equilibrio.
Come avviene la formazione di un precipitato? Essenzialmente per nucleazione o per crescita delle particelle. Nella nucleazione poche unità del complesso analita-agente di precipitazione si aggregano e precipitano mentre nella crescita delle particelle, semplificando, l’analita tende ad associarsi ai nuclei già formati.
Fino ad ora non abbiamo tenuto conto dei sistemi colloidali che sono dei sistemi estremamente stabili in virtù di particolarità che interessano le cariche elettriche. In soluzione un colloide forma una caratteristica struttura a doppio strato; il primo strato è dato da una serie di molecole, o più probabilmente atomi, aventi una stessa carica (positiva o negativa) che circonda il colloide. Il secondo strato è dato da una serie di atomi con una carica opposta rispetto al primo strato. Per far precipitare lo strato colloidale, solitamente, si utilizza un elettrolita capace di ridurre il volume del doppio strato nel fenomeno della coagulazione. Un effetto che dal punto di vista temporale segue alla coagulazione è quello della peptidazione; i precipitati devono essere purificati mediante dei lavaggi che potrebbero allontanare l’elettrolita. In questo modo si potrebbe ripristinare la forma colloidale dell’analita che, di conseguenza, condurrebbe ad un esito falsato. Per evitare questo problema si esegue un lavaggio con un elettrolita che verrà allontanato successivamente mediante volatilizzazione.
Un altro fenomeno di cui tener conto è quello della coprecipitazione. Quando si aggiunge un agente precipitante questo potrebbe far precipitare altri elementi, ad esempio ioni o molecole presenti in soluzione o perfino negli strati colloidali. Per ridurre i fenomeni di coprecipitazione si riscalda la soluzione o la si mescola.
Migliorare l’analisi gravimetrica
-Uso di agente precipitante molto diluito.
-Uso del precipitante con il metodo “goccia a goccia”, avendo cura di mescolare la soluzione.
-Utilizzare un agente precipitante in fase omogenea.
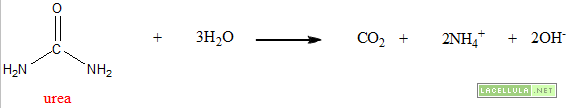
Per ciò che concerne la fase omogenea si utilizza una reazione direttamente nella soluzione mediante la quale si forma un agente precipitante. Il classico esempio è dato dalla formazione di OH– a partire da urea.