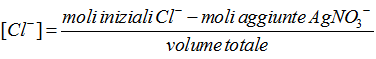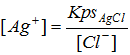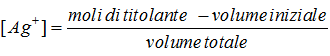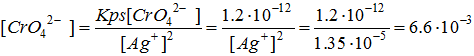Indice
L’argentometria racchiude le tecniche analitiche utilizzanti l’argento come titolante che sfruttano i principi di sintesi di molecole con una limitata solubilità che, in soluzione, precipitano. La molecola maggiormente usata nell’analisi argentometrica è il nitrato di argento (AgNO3).
La titolazione basata sulla reazione di precipitazione del nitrato di argento è di prima scelta quando si necessita di titolare gli alogenuri, i mercaptani, i cianati, i tiocianati ed altre molecole.
Il metodo argentometrico non si discosta molto, almeno in linea teorica, dal metodo volumetrico di titolazione acido base visto precedentemente e diverge soltanto in alcuni aspetti. La curva di titolazione possiede un diverso parametro che è il pAg, ovvero la concentrazione in termini di logaritmo negativo dell’argento, che prende il posto del pH. Come si calcola questo parametro? processo di titolazione è possibile imbattersi in tre eventi:
[-] Nessuna aliquota di nitrato di argento inserita. All’inizio, quando non è stato aggiunto il titolante il parametro pAg non può essere calcolato. Questo perché il -log(0) è indefinito.
[-] Prima dell’equivalenza. In genere la concentrazione del catione argento è troppo bassa per essere calcolata ma può essere facilmente essere ricavata la concentrazione dell’analita, ad esempio lo ione cloro, mediante la formula:
A questo punto è abbastanza facile calcolare la concentrazione dello ione argento dividendo il Kps di AgCl per la concentrazione appena ricavata di Cl–.
[-] Equivalenza. All’equivalenza la concentrazione di Ag+ è pari alla concentrazione di Cl–. Allo stesso tempo è utile ricordare che la concentrazione di Ag+ è pari alla radice quadrata del Kps de cloruro di argento. In altre parole:
[-] Dopo l’equivalenza. Superato il punto di equivalenza si calcola la concentrazione dello ione argento mediante la formula:
Nell’argentometria è di fondamentale importanza l’utilizzo di un indicatore; in base al tipo di molecola utilizzata si distinguono tre tipi di analisi: metodo di Mohr, metodo di Volhard e metodo di Fajans.
| Metodo | Descrizione |
| Metodo di Mohr | Si utilizza per le soluzioni neutre o lievemente basiche per le analisi di alcuni alogenuri. È preferibile una soluzione basica poiché a pH acido l’indicatore (cromato di sodio) rimane maggiormente nella forma dissociata e poiché si potrebbe formare lo ione dicromato che è molto solubile. |
| Metodo di Fajans | Reazione che utilizza la fluoresceina come indicatore per lo ione cloruro. È un metodo di assorbimento più che di precipitazione perché il Kps del fluoresceinato di argento non viene mai oltrepassato. |
| Metodo di Volhard | Metodo che utilizza il Fe(III) come indicatore ed il tiocianato come titolante. È una tecnica poco adatta per le soluzione alcaline perché il ferro precipiterebbe sotto forma di idrossido di ferro. |
Metodo di Mohr
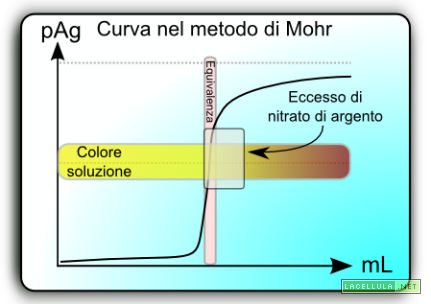
Qual è il meccanismo di funzionamento del metodo di Mohr? Inizialmente il campione ha una concentrazione sconosciuta di cloruro che l’operatore deve rilevare. Il preparato deve avere una concentrazione lievemente alcalina con un pH tra 7 e 9 , questo perché se l’ambiente risultasse acido si potrebbe formare lo ione dicromato che è estremamente solubile. Qualora l’ambiente fosse estremamente basico si potrebbe formare idrossido di argento (AgOH) o ossido di argento (Ag2O). In ambedue i casi il test potrebbe essere falsato.
Come si calcola il punto di equivalenza? Il punto nel quale si ha una equimolarità tra Ag+ e Cl– può essere semplicemente calcolato dal prodotto di solubilità di AgCl:
Una volta ottenuto questo valore è possibile calcolare la concentrazione del cromato alla quale si inizia a formare il cromato di argento mediante una semplice formula
A questo punto è necessario fare una considerazione. Potrebbe sembrare plausibile calcolare la concentrazione dello ione cromato necessaria per arrivare al punto di equivalenza. In realtà al punto di equivalenza la soluzione possiede un colore giallo intenso che sovrasta il rosso del cromato di argento; per questo motivo è necessario inserire una piccola aggiunta di nitrato di argento per poter formare una aggiunta di cromato di argento che conferisce alla soluzione una colorazione rosso intenso
Metodo di Fajans
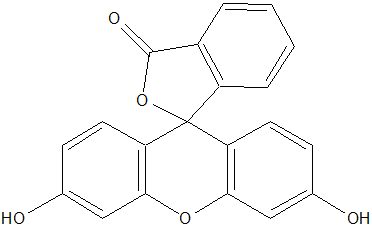
La fluoresceina è un acido organico debole e in soluzione è presente nella forma ionizzata. Il nitrato di argento introdotto serve a formare una certa quantità di AgCl che si aggrega a formare una sostanza colloidale. Se nell’analisi gravimetrica la presenza di elementi colloidali è un problema in quanto questi non possono essere filtrati, nella analisi ad assorbimento è uno dei requisiti di maggiore importanza. La fluoresceina, infatti, interagisce in modo ottimale con la superficie della particella colloidale che, per quanto piccola possa essere, espone un elevato numero di atomi di cloro e argento.
Prima dell’equivalenza la concentrazione di Cl– è maggiore rispetto alla concentrazione di Ag+. Il primo strato di assorbimento, in questo caso, dato proprio dagli ioni Cl– che formano una particella colloidale stabile grazie alle interazioni di repulsione dovute alla presenza della carica negativa. Aggiungendo nitrato di argento si giunge dapprima al punto di equivalenza e, successivamente, si osserva un eccesso di ioni Ag+. Il secondo strato di assorbimento è dato dai cationi argento che vanno a depositarsi sulla particella colloidale. A questo punto l’indicatore può legarsi grazie alla elevata disponibilità di Ag+ e la soluzione cambia di colore diventando rosa.
Per quanto riguarda il pH questo deve essere mantenuto stabile e non può essere troppo acido. La fluoresceina, a pH bassi, tende ad essere presente nella forma non ionizzata e non potrebbe far parte delle reazioni con il secondo strato di assorbimento. Un altro aspetto da tenere in considerazione è dato dal fatto che la fluoresceina è fotosensibile; se la titolazione avvenisse in presenza di un determinato quantitativo di luce si potrebbe introdurre un errore di metodo in quanto la soluzione potrebbe non rispondere come ci si aspetta.
Metodo di Volhard
Per determinare la concentrazione del cloro si sottrae dalla quantità di nitrato di argento inserito in soluzione il numero di moli che hanno reagito per formare tiocianato di argento.
Il metodo di Volhard è generalmente utilizzato per le soluzione a carattere acido.