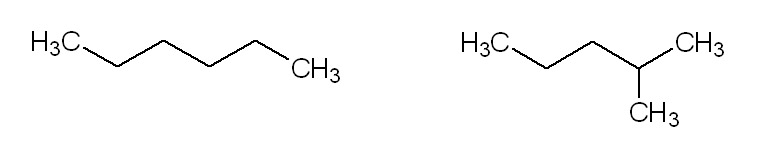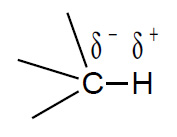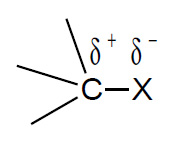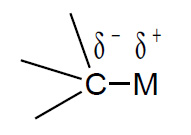Indice
Lo sviluppo di un tema così vasto quale il titolo riporta non può che essere paragonato ad una goccia nel mare e la sua trattazione a mitologiche immagini quali il supplizio di Sisifo. Infatti non esiste reazione per la quale non si possano tracciare regole e contemporaneamente eccezioni che sembrino contraddirle gettando nel panico chi abbia l’ardire di pensare di poterne prevedere a tavolino l’andamento, dati i reagenti e le condizioni di reazione.
Questo è infatti il bello e contemporaneamente il brutto della chimica organica: per quanto Gibbs, Helmoltz, Le Chatelier, Nernst, e tanti altri abbiano lavorato perché le reazioni fossero sempre meglio conosciute dal punto di vista termodinamico e cinetico, un’ ossido-riduzione inorganica (salvo problemi di sovratensione) è in genere prevedibile, una reazione organica mai eseguita in precedenza non lo è, o perlomeno non lo è sempre. Le variabili da considerare sono molte (sempre di più man mano che la complessità della molecola substrato aumenta) ed è molto difficile tenere conto di tutte: ci provano i chimici computazionali con i programmi di molecular modelling ma anche questi ultimi devono utilizzare delle approssimazioni che possono risultare arbitrarie.
Tuttavia insigni ricercatori, Ingold in testa, non si sono dati per vinti e, pezzo dopo pezzo, hanno tracciato dei capisaldi importanti, mostrando che, sì, le regole hanno delle eccezioni ma che, per tale motivo, sono comunque regole di validità spesso molto generale.
In questo articolo ho cercato di riassumere le cose che ritengo essenziali per tentare di capire la reattività organica e la relazione tra questa e le strutture delle molecole considerate.
Tale lavoro non ha certo la pretesa e l’ardire di essere esaustivo, ma, tracciando un sintetico quadro, vuole soltanto indicare un sentiero percorribile da chi, interessato al mondo dei composti organici, voglia partire per un lungo viaggio verso la loro scoperta.
DEFINIZIONE DI COMPOSTO ORGANICO
Il composto organico è un composto che contiene almeno la coppia di elementi carbonio e idrogeno: in tal caso i composti in questione sono definiti idrocarburi. Può altresì contenere anche (ma non solo) uno o più atomi di ossigeno, azoto, fosforo, zolfo, selenio ed anche altro. Il numero dei composti organici conosciuti e di quelli non conosciuti ma possibili è così elevato da essere virtualmente illimitato. Ciò risulta possibile a causa di una peculiarità dell’elemento carbonio: quella di avere una affinità di legame con se stesso unica in tutta la tavola periodica, la quale, unita alla capacità di formare quattro legami chimici per ogni atomo, lo rende capace di costituire un enorme numero di possibili combinazioni di catene lineari o ramificate alle quali possono legarsi atomi di idrogeno e di altri elementi.
Possiamo preventivamente suddividere i composti organici in:
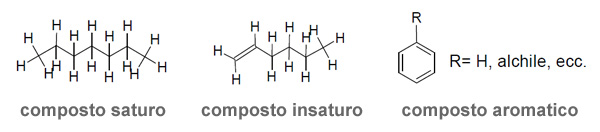
Composti saturi, Composti insaturi, Composti aromatici.
I primi contengono soltanto atomi di carbonio legati tra sé o ad altri atomi mediante legami di tipo σ (sigma).
I secondi possono contenere uno o più atomi di carbonio insaturi, cioè che formano almeno un legame π (pi greco) tra i quattro possibili.
I terzi contengono almeno un sistema di elettroni π in risonanza. Per riconoscere un composto aromatico possiamo utilizzare la regola di Huckel.
π = (4n + 2) con n = 0,1,2,3…
STRUTTURA DEI COMPOSTI ORGANICI
Fatto salvo per i composti aromatici, che formano un capitolo a se stante per quanto riguarda la struttura, i composti saturi ed insaturi contengono tutti una catena di atomi di carbonio (eccezione: il metano che ha un solo atomo di C) legati tra loro da legami σ. Quello che differenzia la struttura dei primi dai secondi è che questi ultimi contengono anche uno o più legami di tipo π.
Possiamo, inoltre, fare altre distinzioni strutturali che ci risulteranno utili in seguito: la prima, tra composti a catena lineare e composti a catena ramificata.
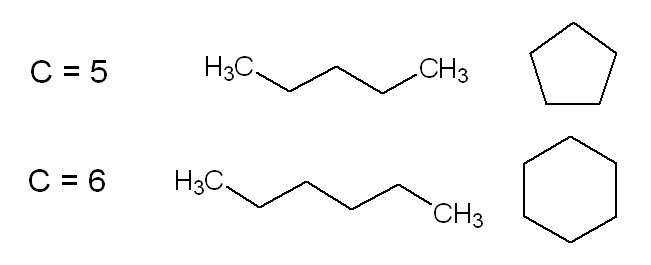
La seconda, tra composti a catena aperta e composti di tipo ciclico.
Queste differenze e distinzioni da me delineate sono utili all’indagine sulla reattività e sulla conseguente relazione tra essa e la struttura che reagisce.
Avendo finora parlato soltanto di composti idrocarburici, è, a questo punto, doveroso sottolineare che l’introduzione di eteroatomi, da soli o in gruppo, modifica le caratteristiche strutturali delle molecole che li contengono sia geometricamente che elettronicamente, modificandone di conseguenza la reattività. Inoltre, la presenza di gruppi funzionali conferiscono alla molecola una reattività particolare: ogni composto funzionale ha la sua.
Composti funzionali
R -X ovvero Ar-X dove; R= alchile; Ar= arile; X= gruppo funzionale.
Esempi di gruppi funzionali: -OH, -NH2, -COOH ecc.
REATTIVITA’ DEI COMPOSTI ORGANICI
Premessa
Un composto organico viene definito substrato, dal momento in cui subisce una reazione da parte di un reattivo. La reazione avviene solitamente non a carico di tutta la molecola ma soltanto di una parte di essa, chiamata sito di reazione, lasciando invariato il resto della molecola.
Sito di reazione
Il sito di reazione è costituito da un legame chimico più reattivo degli altri o da un gruppo di atomi (gruppo funzionale) contenente vari legami più reattivi ovvero più deboli.
La chiave di tale reattività risiede nella diversa elettronegatività degli atomi componenti il sito di reazione. L’atomo di carbonio ha una elettronegatività intermedia, leggermente più elevata dell’idrogeno, ed il legame C-H risulta debolmente polarizzato, mentre il legame C-C non lo è affatto: per questo motivo gli alcani sono poco reattivi ma se reagiscono lo fanno su di un legame C-H.
Tuttavia, se il substrato contiene altri tipi di atomo con maggiore differenza di elettronegatività ci saranno legami con più alta polarità, rispetto ai legami idrocarburici C-C e C-H, e quindi più ricca sarà la reattività. Con atomi più elettronegativi il carbonio forma legami polarizzati in cui esso risulta impoverito di elettroni.
Tale legame richiamerà reattivi di tipo nucleofilo, quali OH–, Cl–, NH3, SH- ecc.
Al contrario, con atomi più elettropositivi la polarità è invertita ed il carbonio reagisce con reattivi di tipo elettrofilo, quali H+, X+, M+ (reattività definita anche di tipo umpolung).
LE REAZIONE ORGANICHE
Esiste un numero piuttosto esiguo di grandi categorie di reazione all’interno delle quali, seppur con qualche peculiarità intrinseca, possono essere collocate quasi tutte le reazioni organiche. Tali categorie possono essere formate tenendo in considerazione il tipo di interazione tra reagenti (substrato, reattivo/i) che sarà determinato sia dal tipo di substrato (leggi sito attivo) che di reattivo. Un certo tipo di substrato ammette solo alcuni tipi di reazione e non altri, un certo tipo di reattivo reagisce più facilmente con un certo tipo di substrato che con un altro (e con alcuni non reagisce affatto).
Anche se categorizzare è pur sempre un atto arbitrario, insigni scienziati lo hanno fatto e alcune di queste categorie sono riconosciute dai più.