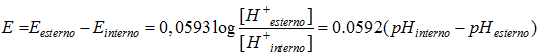Indice
In questa guida spieghiamo in cosa consiste la potenziometria.
Prima di procedere ulteriormente consideriamo la relazione del potenziale elettrodico con la semicella, almeno nelle sue linee teoriche. L’equazione di Nernst mette in relazione il potenziale elettrodico alle concentrazioni delle specie che, nella semicella, lo generano. La forma dell’equazione è la seguente
Dove
E° rappresenta il potenziale standard di riduzione, ovvero l’espressione numerica della “tendenza” di una reazione a procedere verso la riduzione quando la concentrazione dei reagenti è unitaria. Nell’esempio della sbarra di argento immersa nel nitrato di argento E° misura il potenziale standard di riduzione Ag+/Ag
R è la costante universale dei Gas.
T è la temperatura.
n rappresenta il numero di elettroni scambiati durante la reazione (nel caso di Ag+/Ag è pari ad uno, nel caso MnO4–/Mn2+ è pari a 5)
F è la costante di Faraday che esprime la carica in Coulomb posseduta da una mole di elettroni.
Abbiamo visto che l’equazione di Nernst lega le concentrazioni delle specie nella semicella al potenziale elettrodico. Grazie a questo principio è possibile sviluppare un’analisi quantitativa che prende il nome di potenziometria. Utilizzando un elettrodo di riferimento, ovvero una semicella nella quale il potenziale è noto e non varia in base alla concentrazione della specie analita, è possibile determinare la concentrazione di alcune specie chimiche immergendo nella soluzione che le contiene un elettrodo indicatore.
Un tipico elettrodo di riferimento è l’elettrodo a calomelano (Mg2Cl2). Questo è costituito da un tubo di vetro con calomelano e mercurio che, esternamente, è rivestito da un altro tubo di vetro. Lo spazio che si forma tra i due tubi è riempito dal ponte salino costituito da cloruro di potassio. L’elettrodo a calomelano viene interfacciato alla soluzione grazie ad un piccolo foro nel primo tubo, ovvero quello contenente la pasta di mercurio e calomelano, e ad un disco calcinato presente nel secondo tubo.
pHmetri
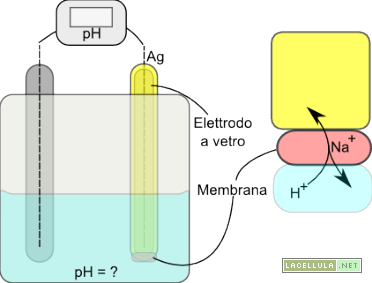
Il pHmetro è lo strumento mediante il quale è possibile stabilire la concentrazione idrogenionica di una soluzione. Ricordiamo che la misurazione del pH viene effettuata secondo la semplice equazione pH = -log[H+]. L’elettrodo indicatore del pHmetro è generalmente un elettrodo a vetro, che approfondiremo appena avanti, che è accompagnato dall’elettrodo a calomelano che serve da riferimento.
Il punto più delicato dell’intero sistema è la piccola zona selettiva dell’elettrodo indicatore che è collegata all’elettrodo grazie ad un filo di argento che lo attraversa per intero. In particolare l’elettrodo a vetro possiede una membrana formata da silicati che “scambiano” ioni Na+, presenti proprio nei silicati, con i protoni della soluzione.
Come funziona un elettrodo a vetro? Torniamo un attimo indietro e rivediamo l’equazione di Nernst
Come è possibile determinare il pH? Ricordiamoci che all’interno dell’elettrodo a vetro non c’è alcuna influenza dalla soluzione esterna. In altre parole l’attività dell’elettrodo di riferimento non dipende dalla soluzione che si analizza e, ovviamente, è ben nota in quanto il produttore costruisce l’elettrodo secondo standard di mercato.
La membrana dell’elettrodo indicatore è selettiva nei confronti dei protoni. Quando l’elettrodo è in soluzione si crea una interfaccia il cui potenziale elettrodico può essere calcolato con l’equazione di Nernst appena vista a patto che, come abbiamo già compreso, sia associato un elettrodo di riferimento che può essere quello a calomelano o l’elettrodo Ag+/Ag. Il potenziale elettrodico viene misurato dal pHmetro che, in questo modo, restituisce il pH della soluzione.
Il pHmetro, da come è possibile immaginare, è uno strumento delicato e costoso. La parte fondamentale di questo attrezzo è l’elettrodo indicatore che, difatti, può essere sostituito. Tuttavia è sempre presente una probabilità di errore che influenza la misurazione. Gli errori sono di diversi tipi e sono schematicamente i seguenti
Membrana alterata. Piccole fratture della membrana, dovute ad esempio agli urti, oppure membrana contaminate da agenti chimici alterano la permeabilità e di conseguenza influenzano negativamente la misurazione.
Errore acido. A pH estremamente bassi (ad esempio pH inferiori a 0,2) l’elettrodo diventa meno sensibile ai protoni con il risultato che il valore letto è superiore al valore “reale” del pH della soluzione.
Errore alcalino. Con soluzione alcaline la membrana perde la selettività specifica per gli ioni H+ e il pH rilevato risulta essere inferiore.
Elettrodi iono-selettivi
Un elettrodo iono-selettivo è sensibile ad uno ione specifico. Esistono differenti tipi di elettrodi iono-selettivi che sfruttano la proprietà della membrana modificata dell’elettrodo a vetro di lasciarsi permeare soltanto da alcuni ioni, particolari membrane liquide o elettrodi ad enzima-substrato che sfruttano l’attività enzimatica per liberare una molecola, ad esempio l’ureasi per liberare urea, che verrà rilevata da un ulteriore elettrodo selettivo.
In linea generale gli elettrodi iono-selettivi sono efficaci, purché manutenzionati, e veloci nel fornire i risultati. Inoltre possono adattarsi a soluzioni non perfettamente limpide in quanto le membrane non sono influenzate da altri fattori esterni. C’è da considerare una maggiore manutenzione rispetto agli elettrodi a vetro, che si traduce in calibrazioni più frequenti e meticolose.