Indice
La complessometria è un approccio analitico che utilizza alcune molecole definite chelanti sfruttando le reazioni di precipitazione di complessi. È una analisi volumetrica poiché si valuta la reazione in base al quantitativo di chelante aggiunto; a tal proposito è opportuno ricordare che la reazione ha una stechiometria certa e conosciuta. Si definisce “certa” una reazione dove un determinato quantitativo del reagente (ad esempio il chelante) reagisce con un altrettanto determinato quantitativo di molecola.
Chelometria
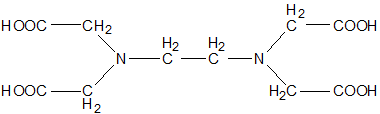
La molecola principalmente utilizzata per ciò che concerne le analisi complessometriche è l’EDTA (acido etilendiaminotetraacetico) che è capace di chelare un buon numero di cationi
L’EDTA si lega, tra gli altri cationi, a Ca++ e Mg++. Questo legame risulta essere aspecifico nel senso che, a pH neutro, l’EDTA si lega in modo casuale sia agli ioni calcio che magnesio. Per poter, quantitativamente, stabilire la concentrazione del calcio è necessario portare il pH della soluzione a 12 utilizzando, ad esempio, idrossido di sodio. In questo modo il magnesio precipita sotto forma di idrossido di magnesio e il calcio può essere chelato. A questo valore di pH si utilizza come indicatore il blu di idrossinaftolo che lega a sé gli ioni calcio. L’EDTA aggiunto lega a sé gli ioni calcio della soluzione e, una volta terminati, sottrae il calcio legato all’indicatore. Il colore della soluzione vira da rosa ad azzurro.
Retrotitolazione con EDTA
La retrotitolazione con EDTA implica l’inserimento in soluzione di una quantità in eccesso del chelante. Questo eccesso viene “retrotitolato” con una soluzione standard di magnesio o zinco; il tutto in presenza dell’indicatore Nero eriocromo T.
L’utilizzo della retrotitolazione è necessario in presenza di cationi che reagirebbero troppo lentamente con l’EDTA per poter essere analizzati o per gli anioni che formano precipitati poco solubili.