Indice
Gli aminoacidi (o amminoacidi) sono delle molecole biologiche presenti in tutti gli organismo indifferentemente dal loro livello di complessità. La loro funzione si svolge su diversi livelli in quanto possono essere delle riserve di energia e venir degradati in momenti di bisogno, possono essere dei segnalatori biochimici e, ancora più importante, sono i costituenti principali delle proteine.
Struttura degli aminoacidi.
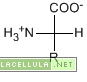
Come il nome stesso suggerisce gli aminoacidi sono molecole aventi sia la funzionalità aminica (NH2) che la funzionalità carbossilica (COOH). La funzione aminica, in particolare può essere presente sia al carbonio alpha che al carbonio beta tuttavia, in natura, gli aminoacidi costituenti le proteine sono presenti soltanto nella loro forma beta.
Gli aminoacidi hanno dunque una struttura tra loro in comune alla quale si lega il residuo che caratterizza l’aminoacido stesso. La struttura fissa è rappresentata da un carbonio tetravalente che lega un carbossile ed un amina, in addizione ad un idrogeno. Il residuo, inoltre, può essere polare, apolare oppure carico in base alla struttura molecolare.
Gli aminoacidi in natura, oltre ad essere alpha aminoacidi, sono tutti della serie L con la funzione aminica idealmente configurata a sinistra. Per distinguere tra L-aminoacidi e D-aminoacidi si fa riferimento allo zucchero chirale gliceraldeide.
Tutti gli aminoacidi, ad eccezione della glicina, possiedono un centro chirale ovvero un carbonio ibridizzato sp3 avente tre quattro sostituenti differenti.
Proprietà degli aminoacidi.
Gli aminoacidi hanno delle particolari proprietà chimico fisiche. I loro gruppi aminici e carbossilici, e gli eventuali gruppi nel residuo, sono presenti in forma dissociata essendo in soluzione per cui, in base ai valori fisiologici, raggiungono un equilibrio chimico. I due valori tipici delle specie in equilibrio sono il pH ed il pK e risultano fondamentali per comprendere le proprietà degli aminoacidi.
Gli aminoacidi, inoltre, sono degli ioni dipolari o zwitterioni in quanto possono essere sia molecole capaci di accettare protoni che donarli. In biochimica il termine zwitterione si utilizza prevalentemente con gli aminoacidi in quanto le altre molecole capaci di comportarsi da acidi o da basi vengono definite anfotere o anfolitiche.
Acidità del gruppo carbossilico primario e laterale
Per spiegare l’acidità del gruppo carbossilico, sia esso primario o laterale, prendiamo ad esempio la dissociazione dell’acido acetico ed il relativo equilibrio
Il pK è il valore del pH nel quale forma indissociata (CH3COOH) e forma dissociata (CH3COO–)sono presenti in quantità equiparabili e nel caso dell’acido acetico tale valore è pari a 4.76. Questo vuol dire che se la soluzione ha un pH pari a 4.76 esisteranno un egual numero di moli di forma indissociata ed un egual numero di moli nella forma dissociata. A questo punto viene logico pensare che anche il gruppo carbossilico dell’aminoacido abbia tale valore. In realtà non è così e i valori di pK dei carbossili variano a seconda dell’aminoacido in considerazione ma, in genere, sono tutti molto più bassi rispetto al pK dell’acido acetico. Questo perchè l’effetto elettron attratore dell’azoto immediatamente vicino al carbossile esaspera la sua perdita di un idrogeneno rendendolo di molte misure più acido.
| Nome | pK (COOH) | pK (NH) | pK (R) | pI |
| Aspartato | 2.10 | 9.82 | 3.86 | 2.98 |
| Alanina | 2.35 | 9.87 | 6.11 | |
| Arginina | 2.01 | 9.04 | 12.48 | 10.76 |
| Asparagina | 2.02 | 8.80 | 5.41 | |
| Cisteina | 2.05 | 10.25 | 8.00 | 5.02 |
| Fenilalanina | 2.58 | 9.24 | 5.91 | |
| Glicina | 2.35 | 9.78 | 6.06 | |
| Glutammina | 2.17 | 9.13 | 5.65 | |
| Glutammato | 2.10 | 9.47 | 4.07 | 3.08 |
| Isoleucina | 2.32 | 9.76 | 6.04 | |
| Istidina | 1.77 | 9.18 | 6.10 | 7.64 |
| Leucina | 2.33 | 9.74 | 6.04 | |
| Lisina | 2.18 | 8.95 | 10.53 | 9.74 |
| Metionina | 2.28 | 9.21 | 5.74 | |
| Prolina | 2.00 | 10.60 | 6.30 | |
| Serina | 2.21 | 9.15 | 5.68 | |
| Tirosina | 2.20 | 9.11 | 10.07 | 5.63 |
| Treonina | 2.09 | 9.10 | 5.60 | |
| Triptofano | 2.38 | 9.39 | 5.88 | |
| Valina | 2.29 | 9.72 | 6.00 |
Basicità del gruppo aminico
Il gruppo aminico di un alpha-aminoacido è leggermente meno basico della corrispondente amina alifatica per i motivi opposti illustrati nel paragrafo precedente. La media del pK dei vari aminoacidi si attesta circa a 9.70 ben al di sotto del valore di pH di una generica amina alifatica che è pari a circa 10,80.
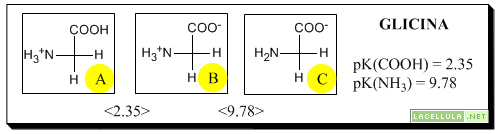
Punto isoelettrico di un aminoacido
Il punto isoelettrico di un aminoacido è rappresentato dal valore di pH nel quale la sua carica interna netta è pari a zero. Prendiamo ad esempio la glicina che ha il valore di pK della funzionalità carbossilica pari a 2.35 e il valore di pK della funzionalità aminica pari a 9.78. Questo vuol dire che a valori di pH inferiori a 2.35 il suo carbossile sarà più presente nella forma non dissociata e l’amina sarà prevalentemente protonata. A pH maggiore di 9.78, invece, si verifica l’opposto con il carbossile privo dell’idrogeno e con l’azoto non ionizzato. Il punto isoelettrico della glicina, pertanto sarà dato dalla media tra il valore del pK del gruppo carbossilico ed il valore del pK del gruppo aminico.