Indice
Tra i parametri più comunemente utilizzati per esprimere e misurare la “quantità” disponibile di un dato materiale, sia esso una sostanza chimica pura come anche una miscela complessa ed eventualmente incognita, vi sono sicuramente il volume ed il peso.
Nel corso della mia esperienza personale ho avuto modo di accumulare tutta una casistica di argomentazioni fra loro diversissime che tuttavia quasi all’unanimità concordano nel valorizzare la scelta della gravimetria (nome nobile per indicare la misura del peso, tramite bilance), a scapito della volumetria sia per la misurazione che per il dosaggio di sostanze, sia liquide che solide, non soltanto nella realtà dei laboratori chimici, ma ovunque si presenti la necessità di misurare la quantità di una determinato materiale sfuso, quindi anche in cucina e nei laboratori artigianali.
La preferenza per le misurazioni in peso, specie se condotte con gli accorgimenti pratici e concettuali che avrò modo di descrivere fra poco, diventa ancora più importante nella prospettiva dell’impiego delle sostanze pesate in vista della preparazione di soluzioni o miscele multicomponenti e per l’allestimento di set di campioni a diversa concentrazione.
VARIABILI E LIMITI DELLA VOLUMETRIA: IL PROBLEMA DELLA DENSITA’ VARIABILE
LA RAGIONE PRATICA NELLA DISPENSAZIONE VOLUMETRICA
Esistono però anche altre ragioni, queste invece di natura pratica, per le quali il ricorso al volume risulta solitamente meno affidabile rispetto alla misura del peso per indicare la “quantità” di una determinata sostanza. Parlo del fatto che, a parità di fascia, gli strumenti di laboratorio utili per la misura dei volumi (es. burette, matracci tarati, pipette, ecc) risultano di fatto meno precisi ed accurati, nonché meno discriminanti, di quelli impiegati per
la misura dei pesi (bilance). Anche la quantità minima misurabile potrebbe costituire un problema, soprattutto in relazione alla possibilità dell’inserimento di bolle d’aria (di non sempre facile rimozione) all’interno dei minuscoli e strettissimi contenitori impiegati per dosare frazioni di millilitro di liquidi: si pensi alle microsiringhe usate per le iniezioni cromatografiche, per le quali sono spesso richieste varie stantuffate di riempimento/svuotamento della siringa (operazione nota anche come “avvinamento”) finalizzate al bagnamento delle pareti interne del contenitore e quindi alla successiva riduzione nella formazione e trattenimento di bolle d’aria.
Ma c’è di più, e questa volta in direzione della perturbazione dell’altro fondamentale parametro di misura, quello della precisione: la creazione del menisco. Avete mai notato che, specie nei contenitori più stretti, ad esempio nei colli dei matracci così come nelle burette, la linea di demarcazione superiore del livello del liquido appare “più spessa”, e per la precisione assume una forma lenticolare, più bassa al centro e più alta in corrispondenza delle pareti del contenitore? Si tratta di un fenomeno ben studiato dai fisici che deriva da fenomeni di adesione fra le molecole del liquido e quelle del materiale di cui è costituito il contenitore e sta alla base di altri fenomeni come quello della risalita capillare, visibile con chiarezza solo nei condotti più ristretti. Dal punto di vista delle misure volumetriche la formazione del menisco complica non di poco la valutazione visiva del livello raggiunto dal liquido, introducendo in essa una componente soggettiva. Quando lo spessore del menisco inizia a farsi importante (fino ad un paio di millimetri, in dipendenza sia del tipo di liquido che della sezione del contenitore), ci si potrebbe domandare se fare riferimento al valore della graduazione alla base di questa piccola lenticchia, a quella posta sul suo lato superiore o, eventualmente, a quella centrale. Per convenzione si è scelto di fare riferimento alla “pancia” del menisco, ovvero a fissare il volume con riferimento alla graduazione corrispondente al limite inferiore di questa lenticola.
Nonostante tutte queste limitazioni, il ricorso al volume può risultare estremamente agevole quando si renda necessaria la dispensazione veloce, reiterata e magari non necessariamente rigorosissima di piccoli volumi di liquido. E’ il caso della pipettatura, l’operazione con la quale l’operatore si trova a prelevare da un contenitore e trasferire in un un altro, magari centinaia di volte al giorno, volumi dell’ordine di alcuni millilitri o anche di
frazioni di questi. La temperatura ambientale è piuttosto ben controllata, il materiali di cui sono fatti i contenitori (di solito puntali monouso su pipette automatiche) sono molto ben conosciuti e comunque una limitata incertezza relativamente al volume effettivamente erogato nelle varie ripetizioni dell’operazione è considerata tollerabile nell’ambito dell’applicazione specifica. La pipettatura trova larghissima applicazione nelle operazioni quotidiane presso i laboratori di analisi ed in particolare quelli che operano nei settori inerenti la biologia, ovvero quello biochimico, la biologia molecolare e l’analisi clinica: la richiesta di sistemi veloci, pratici e privi di contaminazione fra dipensazioni successive di campioni diversi hanno portato la aziende produttrici a mettere a punto sistemi estremamente egonomici, dove solo il puntale monouso della pipetta entra in contatto con il liquido e viene poi scartato per eplulsione al termine della dispensazione, dando la possibilità di caricare ad ogni pipettata un puntale nuovo. Sempre in direzione della maggiore velocità di esecuzione di questa che spesso è da ritenersi l’operazione con intervento umano più ripetuta in molti laboratori, vengono le pipette multicanale, in grado di caricare e successivamente erogare simultaneamente fino ad una decina di piccoli volumi, parallelamente, da contenitori di partenza a contenitori di arrivo, di solito batterie di piccole fialette in plastica parzialmente unite l’un l’altra o addirittura piastre preformate con piccoli pozzetti in grado di raccogliere anche soltanto un millilitro di volume.
COSA SI INTENDE REALMENTE PER PESATA
Sul fascicolo che descrive la preparazione della nostra miscela, ad esempio l’impasto per una torta ccosì come una miscela reattiva, oppure anche la posologia di un farmaco, è riportata una dicitura del tipo “aggiungere 5 g della sostanza X”. Allora quello che facciamo è andare a prendere il barattolo di X, solido o liquido che sia, purchè suddivisibile in piccole porzioni, effettuiamo la taratura del nostro contenitore di raccolta sulla bilancia, ovvero azzeriamo la lettura, ed iniziamo poco per volta, molto gradualmente, ad aggiungere X facendolo scendere nel contenitore tramite un cucchiaino o un contagocce, fino a raggiungere il peso di 5 g.
Come si risolve allora il problema di natura pratica di isolare una quantità definita di sostanza, ovvero quello descritto nel secondo caso? Come prima cosa dovremmo iniziare a domandarci per quale motivo ci sia richiesto di isolare questa determinata quantità di sostanza: scopriremo che nella maggior parte dei casi il fatto di aver isolato una porzione leggermente inferiore o leggermente superiore di sostanza è comunque accettabile, purché il peso “reale” di questa porzione isolata sia comunque noto.
Vi faccio un esempio, riprendendo quello dei 50 g di sostanza K richiesti per la preparazione. Lo scopo era quello di preparare una soluzione di K a 50 g/kg in acqua. Con tutta la buona volontà noi ci sforziamo di pesare “esattamente” 5 g ma anche a causa della natura corpuscolare, per quanto finemente suddivisa della polvere, o per la natura viscosa del liquido che lo porta a cadere nel contenitore di raccolta in forma di gocce, non è possibile aggiungere o togliere dal contenitore di pesata porzioni infinitamente piccole di sostanza. L’operazione di “sottrarre” dal contenitore di pesata (sia esso un rettangolino di carta velina, una barchetta di alluminio, un matraccio o un bicchierino) una porzione di sostanza già appoggiatavi, e di rimetterla nel contenitore di partenza, è in tutti i casi un’operazione fortemente sconsigliata, se non altro per il rischio di contaminazione della stessa alla quale potrebbe andare incontro durante l’operazione di estrazione, contatto con l’aria e reintroduzione nel contenitore di partenza. Quindi, se possibile, cercando comunque di evitare di sprechi, dovremmo sempre cercare di “aggiungere” e mai di “togliere” materiale dal contenitore di pesata sulla bilancia.
Con una semplice proporzione matematica
LE CIFRE SIGNIFICATIVE NELLA PESATA
IL PROBLEMA DELLE DILUIZIONI
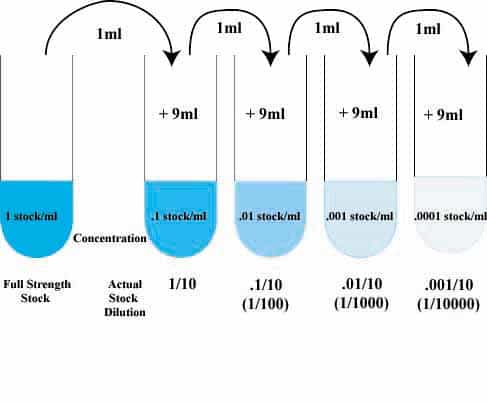
Risulta chiaro come talune concentrazioni, quelle più ridotte, non si possono ottenere per pesata diretta della quantità di standard necessaria, proprio perché questa risulterebbe il molti casi al di sotto, o comunque molto vicina, al limite di sensibilità della bilancia. Non possono pesare 50 milligrammi di una polvere, richiesta per la preparazione di 100 ml di una soluzione a concentrazione 50 mg/l00 ml su di una bilancia che discerne solo i decimi di grammo. Ragionevolmente avremo davanti due strade: una di queste consisterà nel pesare una quantità decisamente maggiore di standard, ad esempio 1 o più grammi della stessa sostanza e quindi diluirlo in una
quantità proporzionalmente maggiore di solvente. Anche se questo metodo risulta probabilmente il meno approssimato, comporta tuttavia diverse difficoltà di ordine pratico: in primo luogo il dispendio economico di grande quantità di standard e di solvente, spesso (soprattutto il primo) estremamente costoso e difficile da reperire in grandi quantità; in secondo luogo la logistica ed il costo di smaltimento del rifiuto prodotto, perché magari per l’applicazione richiesta bastavano poche gocce di soluzione diluita a 50 mg/100ml mentre per le suddette necessità di ne abbiamo dovuti preparare vari litri; in ultimo, la necessità di poter disporre di contenitori di grande capacità, la cui gestione e pulizia potrebbe non risultare così immediata in un laboratorio chimico abituato a ragionare in termini di matracci e provette. Questo approccio tuttavia avrebbe il vantaggio di effettuare una pesata unica e per di più di una quantità di prodotto non pericolosamente al limite della capacità risolutiva della bilancia stessa.
NON PERDERE MATERIALE STRADA FACENDO
Una delle difficoltà più insidiose alle quali l’operatore deve far fronte in sede di preparazioni è quello di assicurarsi del trasferimento completo della sostanze che sta manipolando.
Il materiale, specie se solido, una volta pesato può infatti non sciogliersi perfettamente o rapidamente nel solvente che gli viene aggiunto, e se la quantità di materiale è molto ridotta (ad esempio pochi granelli) può risultare davvero difficile accertarsi a vista del fatto che la dissoluzione sia di fatto completa. Se non lo fosse, quando successivamente preleverò una porzione di soluzione dal contenitore, questa sarà ad una concentrazione minore di quella che ci saremmo aspettati.