L’acqua è debolmente dissociata secondo l’equilibrio
H2O = H+ + OH-
In accordo con la legge di azione di massa, la costante di equilibrio di questa reazione è
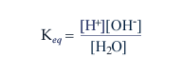
che a 25°C vale ca. 1.8 x 10-16 mol/litro.
Tale valore indica che il numero. di molecole di acqua dissociate è estremamente piccolo in confronto al numero. di molecole di acqua indissociate: solo 2 molecole di acqua su circa 1 miliardo sono presenti in forma dissociata. A causa di questa debole dissociazione, la concentrazione molare dell’acqua può essere considerata costante; pertanto il suo valore può essere “inglobato” nella costante di equilibrio, in modo da definire una nuova costante, detta Kw, che vale
![]()
Possiamo quindi scrivere che
![]()
Questa relazione si definisce prodotto ionico dell’acqua ed è di fondamentale importanza per descrivere gli equilibri in soluzione acquosa.