Indice
L’acido solforico è una delle sostanze maggiormente utilizzate nelle industrie chimiche tanto che il suo consumo è un indice delle attività chimiche di una nazione. Secondo la nomenclatura IUPAC il suo nome dovrebbe essere acido tetrossosolforico (VI) ma, come per l’acido nitrico, la stessa IUPAC consente l’uso del nome comune con il quale è universalmente noto. L’acido solforico è noto fin dal XII secolo, conosciuto come spirito di vetriolo. Con il nome di acido solforico si intendono miscele di acido e acqua in diverse proporzioni. L’acido al 100% è rappresentato da un rapporto SO3:H2O di 1. Oltre all’acido solforico esistono anche soluzioni ottenute facendo assorbire il triossido di zolfo nell’acido solforico. Tali soluzioni sono note con il nome di oleum o acido solforico fumante e possono raggiungere concentrazioni di S03 libera fino al 60%. Le concentrazioni degli acidi possono essere espresse, oltre che in percentuale, anche in gradi Baumé (°Bé) definiti in maniera diversa in Francia e Germania rispetto ai paesi anglosassoni.
Termodinamica della reazione
La reazione di formazione dell’acido solforico è la seguente
![]()
La reazione è esotermica, per cui un aumento di temperatura sposta l’equilibrio verso sinistra. Poiché è una reazione molto lenta sono stati studiati metodi diversi per catalizzarla.
I metodi di produzione industriale dell’acido solforico sono sostanzialmente due
—metodo all’ossido d’azoto (NO), detto anche alle camere di piombo;
—metodo di contatto.
II primo metodo è stato modificato nel 1745, anno in cui furono introdotte nella produzione le camere di piombo che sostituirono i precedenti recipienti di vetro, dalle quali ha preso il nome e nelle quali avviene l’assorbimento del triossido di zolfo in acqua.
Il secondo metodo ha rappresentato una grande rivoluzione nella preparazione dell’acido solforico e risale al 1881. Questo metodo non prevede l’uso degli ossidi di azoto e si basa sulla trasformazione
![]()
La reazione condotta a temperatura ambiente avviene molto lentamente ed è necessario aumentare la temperatura per aumentare la velocità della reazione. Tuttavia essendo la reazione esotermica è sfavorita dal punto di vista termodinamico da eccessivi aumenti di temperatura, dato che la K diminuisce all’aumentare della temperatura. Infatti a 773,15 K la resa in triossido è del 93%, resa che scende al 40% alla temperatura di 1053,15 K, per cui negli impianti industriali non si supera la temperatura di 723,15 K. La reazione è favorita dall’aumento di pressione dato che avviene con diminuzione di volume, tuttavia è preferibile non incrementare questo parametro perché i vantaggi ottenuti in pratica non sono compensati dai costi necessari per la compressione dei gas. I due metodi sono concorrenziali anche se la tendenza attuale è quella di privilegiare quello di contatto.
Cinetica della reazione
II meccanismo proposto per spiegare la formazione dell’acido solforico con il metodo all’ossido di azoto è molto complesso; sono state proposte diverse teorie che concordano tutte nell’ affermare che l’ossidazione del diossido di zolfo non viene effettuata direttamente dall’ossigeno, ma procede attraverso la formazione di composti intermedi a base di ossidi di azoto. Le teorie più moderne hanno dimostrato che le reazioni che concorrono alla formazione dell’acido sono
In fase gassosa
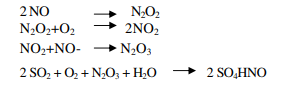
In fase liquida
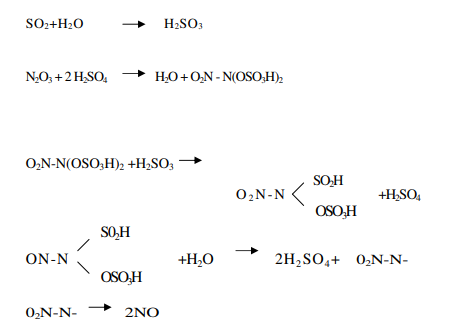
In questo processo la catalisi è di tipo omogeneo, in quanto, come sopra illustrato, gli ossidi d’azoto intervengono formando vari composti, fra i quali un posto di rilievo è occupato dall’acido nitrosil-solforico la cui formula è SO4HNO. Per il meccanismo di preparazione dell’acido solforico nel tempo si sono avute molte teorie che prevedevano intermedi diversi. Nel metodo di contatto, la catalisi è di tipo eterogeneo e prevede l’uso di varie sostanze che agiscono in maniera diversa. I catalizzatori più utilizzati sono il platino e varie sostanze a base di ossidi di vanadio. Alcune volte viene anche impiegato il ferro come precatalizzatore. Il platino permette di lavorare con percentuali più alte di diossido di zolfo, ma presenta costi maggiori e una durata del potere catalitico più breve fra una rigenerazione e l’altra. Come tutte le reazioni chimiche, la velocità è proporzionale alla temperatura, ma come già riportato, un aumento di temperatura sfavorisce le rese, per cui è necessario operare stabilendo un compromesso fra le opposte esigenze. La scelta tecnica consiste nel suddividere il contatto fra i gas e il catalizzatore in più stadi interponendo un sistema di raffreddamento. Di solito in quattro stadi si raggiunge una conversione pari a circa il 98%.
Processo all’ossido di azoto
L’impianto per produrre acido solforico con il processo all’ossido di azoto, noto anche come processo alle camere di piombo, è mostrato nella figura. Il diossido di zolfo proveniente dall’impianto di produzione viene inviato alla temperatura di 573,15-723,15 K nelle torri di Glover; viene investito da una soluzione contenente acido solforico, acido nitrico e ossido d’azoto provenienti sia dalle camere di piombo sia dalle torri di Gay-Lussac. In queste torri vi è una parziale trasformazione dell’SO2 in acido solforico. I gas uscenti dalle torri entrano nelle camere di piombo nelle quali vi è la produzione vera e propria dell’acido desiderato. I gas provenienti dalle camere di piombo contengono basse percentuali di diossido di zolfo e la totalità degli ossidi d’azoto presenti nel ciclo. Questi ultimi vengono assorbiti in torri di Gay-Lussac nelle quali viene inviata la soluzione di acido solforico proveniente dalla torre di Glover. Gli ossidi di azoto non assorbiti vengono perduti e compensati con l’introduzione di acido nitrico direttamente nella torre di Glover. Con questo processo si produce acido al 78%.
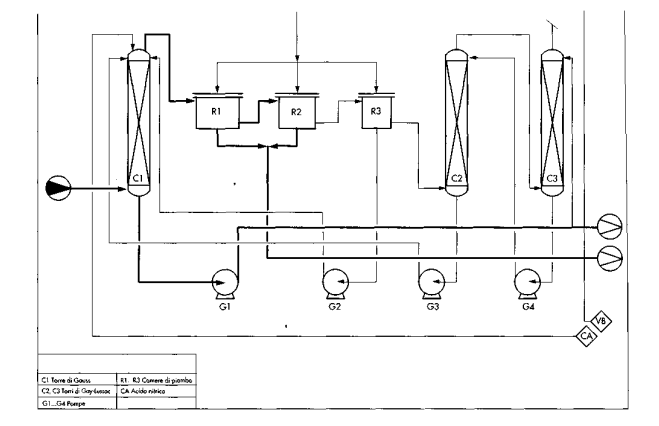
Poiché molte delle reazioni che portano alla produzione di acido solforico avvengono nella fase liquida o all’interfaccia liquido-gas, è importante in ogni fase del processo garantire il massimo contatto liquido-gas. Questo condiziona le scelte tecniche relative alla progettazione delle varie parti dell’impianto che saranno ora brevemente esposte.
Torre di Glover
La torre di Glover è una torre cilindrica o quadrata che poggia su una vasca, rivestita internamente di piombo, contenente acido solforico, equipaggiata da una chiusura idraulica. Il corpo della torre, costituito da un materiale antiacido (ceramica, ghisa antiacida ecc.), presenta all’interno corpi di riempimento tipo anelli Rashing sempre in materiale antiacido (gres, quarzo ecc.).
La torre di Glover in un impianto riveste notevole importanza dato che in essa
—i gas solforasi provenienti dagli impianti di produzione vengono raffreddati da 573,15- 673,15 K a 343,15-353,15 K;
—l’acido solforico proveniente dalle camere viene concentrato per evaporazione dell’acqua fino al massimo valore dell’impianto che si ricorda essere il 78%;
—l’acido nitrico viene decomposto in vapore nitroso;
—l’acido solforico proveniente dalle torri di Gay- Lussac viene denitrato;
—si produce anche una parte di acido solforico dell’intero impianto.
Nella torre di Glover, inoltre, vengono anche abbattute le polveri che accompagnano i gas solforosi provenienti dai forni che sono sfuggiti alle precedenti purificazioni.
Camere di piombo
I primi modelli di camere di piombo erano grandi parallelepipedi poggiati su vasche piene di acido solforico dotati di una chiusura idraulica. In un impianto classico le camere sono quattro e la loro grandezza diminuisce dalla prima all’ultima.
In queste camere il diossido di zolfo viene ossidato a triossido e per ottenere buone rese è necessario che
— la permanenza sia lunga;
— la temperatura non sia troppo elevata;
— vi sia il massimo mescolamento dei gas;
— le superfici delle camere siano grandi perché la maggior parte dell’acido si forma proprio sulle pareti.
Per migliorare le rese, nel tempo sono state proposte modifiche alla forma delle camere di piombo. Le soluzioni proposte e adottate sono numerose e prendono il nome dai loro ideatori. Qui di seguito vengono proposte alcune soluzioni.
Le camere di Meyer sono di forma cilindrica e i gas entrano tangenzialmente dal basso ed escono dall’alto nella parte centrale.
Le camere Moritz sfruttano i moti convettivi dei gas che vengono introdotti caldi nella parte bassa, raggiungono il centro nella parte superiore ed escono nuovamente dal basso passando lungo le pareti.
Il sistema Gaillard Parrisch prevede nelle camere uno spruzzatore circolare che invia l’acido freddo disperso contro le pareti delle camere che hanno una forma troncoconica e sono raffreddate dall’esterno.
Metodi ancora più moderni tendono a sostituire le camere in cui avviene il contatto acqua-vapori solforosi con colonne a riempimento simili alle torri di Glover.
Torri di Gay-Lussac
Le torri di Gay-Lussac, anch’esse rivestite in piombo, sono sospese su una bacinella piena di acido solforico che ne assicura la tenuta. L’interno è pieno di materiali di riempimento antiacido.
In questa apparecchiatura vengono messi a contatto i gas nitrosi provenienti dall’ultima camera di piombo e l’acido solforico proveniente dalla torre di Glover. Il liquido che lascia la torre di Gay-Lussac si chiama nitrosa e contiene il 7-8% di acido nitrosilsolforico. Gli ossidi d’azoto che non vengono assorbiti dall’acido solforico vengono perduti nell’atmosfera. Tale perdita è minima quando il rapporto stechiometrico NO2:NO è 1, come già è stato messo in evidenza nel processo per la produzione dell’acido nitrico. Il recupero degli ossidi di azoto è inoltre influenzato dalla concentrazione e dalla temperatura dell’acido che investe il gas che li contiene.
Un sintomo del cattivo assorbimento degli ossidi è dato dal colore dei fumi che lasciano la torre di Gay-Lussac: se sono bianchi vi è un eccesso di NO2 che reagendo con l’acqua forma acido nitrico, se sono scuri l’NO non è stato sufficientemente ossidato e quindi sfuggendo nell’atmosfera reagisce con l’ossigeno.
Produzione del diossido di zolfo
Finora si è illustrato il metodo utile per trasformare il diossido di zolfo in acido, ora si prende in esame il processo necessario per produrre il diossido di zolfo.
Il diossido di zolfo può essere ottenuto da fonti diverse quali la pirite, la blenda, lo zolfo, il gesso, il solfuro d’idrogeno. La scelta della materia da utilizzarsi per un singolo impianto di produzione dell’acido solforico dipende, come al solito, da considerazioni di carattere economico, legate principalmente alla disponibilità della materia prima che a volte può rappresentare un sottoprodotto di un’altra industria, come per esempio il solfuro d’idrogeno proveniente da una raffineria di petrolio.
I metodi di produzione del diossido dipendono dalla sostanza di partenza. Infatti se si utilizza lo zolfo o il solfuro d’idrogeno, è necessario bruciarli in presenza di ossigeno in forni di varia forma e funzionamento; se si impiegano, invece, i solfuri di metalli quali pirite, galena e blenda, questi devono essere arrostiti facendo in modo che la reazione si fermi alla formazione dell’ossido del metallo e al diossido di zolfo, senza che proceda verso la formazione del solfato del metallo.
Dall’arrostimento dei minerali sulfurei si ottiene un gas solforoso molto sporco di polveri.
Il problema dell’eliminazione delle polveri dai gas solforosi provenienti dai forni è stato a lungo oggetto di studi dato che un gas polveroso crea problemi al funzionamento delle torri di Glover nel processo all’ossido di azoto e le polveri disattivano rapidamente il catalizzatore nel processo di contatto.
Poiché le particelle da eliminare sono estremamente piccole, 0,1-100 u.m, non è possibile usare i classici filtri in quanto non esistono mezzi filtranti in grado di eliminare particelle tanto piccole senza provocare enormi perdite di carico al gas che lo attraversa. Si impiegano allora le camere a urti, i cicloni, i depolverizzatori per lavaggio e, più recentemente, i depolverizzatori elettrostatici che, pur prevedendo consumi enormi di elettricità, rappresentano un notevole miglioramento rispetto agli altri metodi.
Processo di contatto
II processo di contatto, come noto, si basa sull’ossidazione catalitica del diossido di zolfo a triossido che viene effettuata nei forni di contatto, detti anche convertitori, nei quali è posto il catalizzatore. I diversi tipi di convertitori si differenziano per la disposizione interna che può prevedere tubi verticali pieni di catalizzatore o strati di questo supportati da graticci. La reazione di ossidazione è esotermica per cui i convertitori prevedono raffreddamenti interni e/o esterni che mantengono il gas in reazione alla temperatura desiderata; quest’ultima deve variare fra 698,15 e 823,15 K per ottenere le più alte rese.
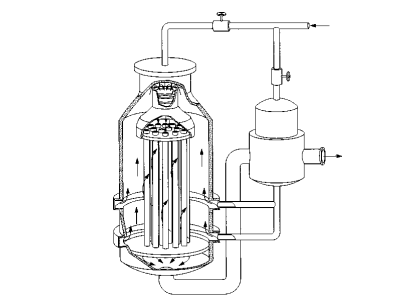
Nella figura è mostrato un convertitore BASF-Knietsch. I gas, preriscaldati in uno scambiatore esterno, entrano nel convertitore dal basso e lo attraversano lambendo i tubi di reazione pieni di catalizzatore. Raggiunta la parte alta del reattore vengono portati alla temperatura corretta miscelandoli con gas freddi; successivamente passano nei tubi per fuoriuscire dalla parte inferiore del reattore. II triossido di zolfo viene quindi inviato negli apparecchi nei quali viene assorbito dall’acqua