La teoria acido base di Arrhenius e la teoria acido base di Bronsted-Lowry spiegano il comportamento dissociativo in soluzione acquosa di alcune molecole. Secondo Arrhenius si definisce acido una sostanza che, disciolta in acqua, libera protoni (H+) e base una sostanza che, sempre in acqua, libera anioni ossidrili (OH–). Abbiamo visto che questa teoria viene perfezionata da Bronsted e da Lowry che definiscono come acido una sostanza che dona protoni e come base una molecola che li riceve. Questa teoria supera il limite della precedente dovuto all’impossibilità materiale che ha un protone di esistere in soluzione senza legarsi ad una qualche altra specie. Queste teorie, comunque, hanno una limitazione dovuta dal fatto che non riescono a spiegare il comportamento acido di alcune sostanze, come il dicloruro di zinco (ZnCL2) o il tricloruro di alluminio (AlCl3) e nemmeno la basicità di molecole come il tricloruro di fosforo (PCl3). Dette molecole, infatti, non possiedono nè protoni nè ioni ossidrili per cui apparentemente non possono caratterizzarsi come basi o come acidi.
Gli acidi e le basi di Lewis.
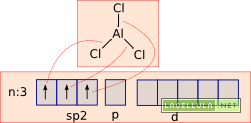
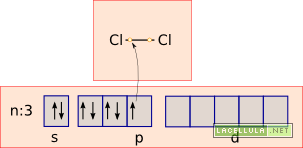
Secondo Lewis gli acidi sono le sostanze capaci di accettare un doppietto elettronico e le basi le molecole che donano un doppietto elettronico. Per comprendere meglio vediamo il caso del tricloruro di alluminio, un catalizzatore inorganico usato nella alogenazione del benzene. Vedremo che tale catalizzatore si comporta da acido di Lewis in presenza di cloro molecolare che, a sua volta, è una base di Lewis.
La struttura del tricloruro di alluminio è la seguente: