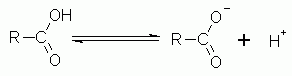Indice
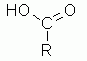
Gli acidi carbossilici sono composti organici aventi un residuo alchilico od arilico legato ad un carbonio ibridizzato sp2. Questo carbonio, chiamato carbonio carbossilico, lega a se con un doppio legame un atomo di ossigeno e un residuo ossidrilico.
Un esempio generico di acido carbossilico è il seguente
Gli acidi carbossilici sono in equilibrio con il loro corrispondente ione chiamato carbossione. L’equilibrio è spesso spostato verso destra ovvero verso lo ione e maggiore è la tendenza ad avere lo ione maggiore sarà l’acidità del composto carbossilico.
Derivati degli acidi carbossilici.
I più importanti derivati degli acidi carbossilici presentano il gruppo funzionale OH sostituito da un altro gruppo funzionale. Gli esteri hanno una catena carboniosa, gli alogenuri un atomo di Cloro, Boro, Iodio o Fluoro, le ammidi hanno il gruppo NH2 e le anidridi hanno un gruppo R-CO legato all’ossigeno dell’acido carbossilico. Per questo motivo le anidridi possono essere simmetriche qualora i due gruppi legati dall’ossigeno centrale sono uguali o asimmetriche.
Acidità degli acidi carbossilici
Come il nome stesso suggerisce gli acidi carbossilici sono composti organici dal carattere acido. La loro acidità non è paragonabile a quella degli acidi forti inorganici, come ad esempio l’acido cloridrico o l’acido solforico. Gli acidi carbossilici neutri sono in equilibrio con la loro forma ionizzata come nell’ esempio di sotto
La reazione è più o meno spostata verso destra a seconda della stabilità dello ione che prende il nome di ione carbossilato. Un composto ionico più stabile determina una maggiore acidità dell\’acido carbossilico. La stabilità dipende da eventuali gruppi elettron attrattori collegati al carbonio carbonilico (effetto di mesomeria positiva o M+). Maggiore è la tendenza ad attrarre elettroni maggiore sarà la tendenza dell’ acido a protolisarsi fornendo lo ione carbossilato e un protone.
L’acido metanoico (acido acetico, di formula CH3-COOH) ha una costante di dissociazione acida di 1,8 •10-5, l’acido etanoico ha una costante di dissociazione acida pari a 18 •10-5 mentre l’acido trifluoroacetico avendo tre atomi di fluori elettroni attrattori è, allo stesso tempo, molto stabile e fortemente acido. La Ka dell’acido trifluroacetico è para a 0,1