In molti ci siamo chiesti per quale ragione quando il tempo è umido le nostre capigliature tendono a diventare più arricciate. Poi quando ci prendiamo direttamente l’acquazzone in testa, ecco che i nostri capelli diventano lisci come spaghetti scotti. Tutto questo ovviamente partendo dal presupposto di avere i capelli sufficientemente lunghi.
Il cambiamento della forma di un filamento in relazione all’umidità veramente non è una prerogativa unica dei capelli: molti sapranno infatti che l’elemento “sensibile” degli igrometri tradizionali, quelli con il quadrante tondo e la lancetta, utilizzati fino a pochi anni fa nelle nostre case fino all’avvento dei dispositivi digitali, era per l’appunto dei sottili filamenti che non erano “simili” a dei capelli… erano proprio capelli, ed anche di una certa lunghezza!
Si era infatti notato che in relazione dell’aria circostante i capelli umani possono variare la loro lunghezza fino al 2,5% passando dallo zero % di umidità al 100% di umidità relativa.
Significa che se ho un capello lungo 20 cm in un clima secco come quello di un deserto, questo può allungarsi di mezzo centimetro, ovvero fino a 20,5 cm complessivi, passano ad un’atmosfera satura di umidità, come quella della foresta equatoriale. In realtà la variazione di lunghezza non è proprio “lineare”, ovvero non possiamo dire ad ogni intervallo uguale di unidità (ad esempio per ogni aumento di umidità del 10%) il capello si allunghi esattamente della stessa estensione.
Un 2,5% di variazione di lunghezza potrà sembrare poco, ma non è stato difficile con un apposito sistema di levette meccaniche amplificare questa variazione in modo sufficiente per consentire nell’igrometro di muovere una lancetta su una scala graduata che indicasse l’umidità relativa.
Ma torniamo alle ragioni di questo comportamento, andandole come di consueto a ricercare nella natura del materiale, ovvero nella composizione del capello.
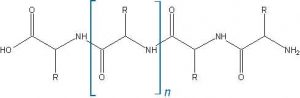
Come molti sapranno il capello, come anche le unghie, è costituito primariamente da cheratina; in quanto proteina la cheratina è costituita da catene lineari di aminoacidi, “mattoncini” disponibili in natura in una ventina di diverse tipologie, la cui esatta sequenza genera la migliaia e migliaia di diverse tipologie di proteine presenti in natura, compresi gli enzimi (anch’essi di natura proteica). In figura ho schematizzato una piccola proteina, quello che i biochimici chiamerebbero un oligopeptide, dove ho evidenziato fra parentesi quadre l’elemento costitutivo di base, ovvero il singolo aminoacido, che si ripete nel corso della catena, con l’unica variazione del gruppo che qui ho chiamato genericamente con R, che è costituito da uno o da un gruppo di atomi, giustificando appunto la differenza fra un aminoacido e l’altro.
In questo momento la caratterizzazione dei singoli gruppi R non ci interessa poi molto: quello che è importante è notare la forma dello scheletro di base della catena, la cussessione di gruppi N-H e C=O (il C è dato per implicito e spesso non lo si scrive neanche nelle strutture di chimica organica, ed è questo il motivo per il quale a volte vedete dei punti nelle formule dove magari c’è una angolo lungo la catena o un punto da cui partono vari legami e non vi è scritto nessun atomo!).
Certo che la semplice successione di questi aminoacidi, quella che si definisce “struttura primaria” per quanto sia il punto di partenza per definire la struttura di una proteina, non spiega da sola molte delle sue proprietà. Non spiega per esempio come la cheratina dei capelli possa farli arricciare con l’umidità.
Il passaggio successivo è quello di riconoscere che ben raramente una proteina si presenterà in natura come una catena informe, o se volete un nastrino liberamente sciolto e libero di flutturare ma al contrario, spinto da forze di natura chimica e fisica di vario genere troverà in qualche modo un assetto più stabile, ovvero assumerà una forma più favorita che potrà essere raggomitolata, avvolta ad elica, certo volendo anche distesa, magari irrigidita come un grissino, ma comunque non casuale e sempre motivata dal tipo e dalla sequenza degli aminoacidi che la compongono e dalla necessità, così universale a questo mondo, di minimizzare l’energia contenuta sistema. Se si pensa ad una molla, si inizia a percepire anche a livello intuitivo che non sempre la posizione distesa risulta quella più spontanea e meno energetica per un oggetto. Pensate anche ad un lungo filo di lana e lasciatelo in casa per dei giorni, magari con bambini ed animali domestici che girano: come pensate di ritrovarlo dopo un mese? Con tutta probabilità bello aggrovigliato in una sorta di grumo!
Sempre in campo di metafore, pensate ad una tradizionale catena metallica fatta da anelli chiusi che legano stabilmente quello precedente e quello successivo. Se gli anelli fossero fatti non di comune acciaio bensì di materiale magnetico, sarebbe prevedibile che ciascun anello ne attirasse degli altri, almeno un altro: oltre al legame stabilissimo fra un anello e l’altro lungo la catena, si verrebbero quindi a creare delle forze, più deboli, che farebbero avvicinare almeno di un po’ anelli della catena non direttamente legati fra loro.
E l’effetto di tutto questo sarebbe quello che la catena invece di starsene liberamente distesa inizierebbe a piegarsi su se stessa, secondo modalità che dipendono fondamentalmente da come si stabiliscono queste ultime forze secondarie, quelle che nella metafora abbiamo ipotizzato magnetiche.
Fra le forme (conformazioni) più comunemente assunte dalle catene proteiche in natura vi è quella dell’avvolgimento in un’elica allungata (la cosiddetta alfa-elica) ed i foglietti beta, dove le catene proteiche sono allineate e strettamente affiancate una di fianco all’altra.
All’origine di entrambe i tipi di conformazioni, che determinano la cosiddetta “struttura secondaria” della proteina, vi è una forza di legame che i chimici definiscono “legame idrogeno” e chi si instaura fra un gruppo donatore di elettroni (N-H) ed un gruppo accettare di elettronico (C=O). Facendo parte della struttura fondamentale di ogni aminoacido esistente, sia N-H che C=O si ripetono continuamente lungo la catena di una proteina.
Quando i legami idrogeno si formano fra gli N-H di una catena proteica ed i C=O di un’altra posta lì accanto, e questo si ripete per molte catene, ecco che si formerà una struttura di una certa rigidità, ovvero un foglietto beta, dove tante catene proteiche saranno affiancate una a lato dell’altra ed in qualche modo tenute vicine dai loro legami idrogeno reciproci.
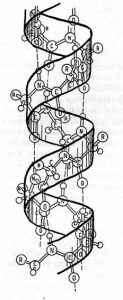
Quando invece i legami idrogeno si formano sempre fra gli N-H ed i C=O ma della stessa catena proteica (la maggiore stabilità per ragioni geometriche-spaziali è fra il N-H di un aminoacido ed il C=O di quello di 4 posizioni più avanti nella catena), la catena proteica tenderà ad assumere una posizione ad elica, dove ogni spira è assoggettata ad un debole legame idrogeno che la avvicina un po’ alla spira che gli sta sotto.
E’ interessante notare come i biochimici, abituati a trattare proteine molto complesse, costituite da centinaia di aminoacidi, ed interessati a vedere come queste si organizzano nello spazio tridimensionale, ovvero che forma esatta assumono, siano soliti rappresentarle in modo semplificato, ovvero senza evidenziare uno per uno gli aminoacidi costituente, ma semplicemente, attraverso delle convenzioni, gli elementi geometrici che ne caratterizzano la struttura secondaria: è così che un’alfa-alica assumerà per l’appunto la forma di un nastrino avvolto ad elica, un foglietto beta di una freccia dritta, e così via anche per altri tipi di moduli caratteristici.
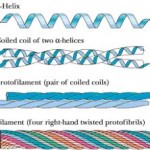
Nel caso della cheratina la struttura ad elica è in assoluto quella che caratterizza di più la proteina, tanto che accade che due catene di circa 300 aminoacidi (lunghezza circa 0,0000007 mm complessivi) ciascuna avvolte ad elica si avvolgano reciprocamente fra loro nello stesso verso di accoppiamento (come illustrato in figura), formando una struttura chiamata protofilamento e che a loro volta due coppie di eliche già avvolte (in pratica due protofilamenti) si accoppino ancora fra loro, formando quello che si definisce una protofibrille. 4 protofibrille si avvolgono reciprocamente per costituire una microfibrilla o filamento (totale 16 alfa-eliche), ed infine le microfibrille si organizzano per formare le macrofibrille…
Da qui non è difficile immaginare intuitivamente come ci stiamo spingendo via via verso una struttura filamentosa ed allungata, qualcosa che siamo abituati a chiamare capello.
Tuttavia non ho ancora spiegato la ragione per la quale i capelli cambiano forma con l’umidità, ovvero tendono ad arricciarsi e seppur di solo il 2,5% massimo, anche ad allungarsi in condizioni di umidità elevata.
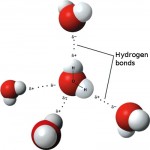
La molecola più diffusa in natura in grado di stabilire degli ottimi legami idrogeno è l’acqua. Se non fosse per i forti legami idrogeno che si stabiliscono fra le molecole di acqua vicine fra loro, questa sostanza non si presenterebbe come liquida, bensì come vapore a temperatura e pressioni ambientali.
Le terminazioni polari N-H e C=O della cheratina, come d’altronde quelle di qualsiasi altra proteina, possono “idratarsi” legando debolmente acqua tramite legami idrogeno; ogni molecola di acqua potrà allo stesso modo stabilire deboli legami con altre molecole sempre di acqua, finchè ad un certo punto l’ennesima molecola di acqua tornerà a stabilire un legame idrogeno con un altro dei gruppi polari della proteina. In pratica una o più di una molecola di acqua (singolarmente molto molto piccole rispetto alla dimensione dell’elica di chetatina) possono fungere da ponte fra una parte della catena ed un’altra, ad esempio fra una spira e quella successiva.
Quando la cheratina è molto idratata, i ponti fra una spira e l’altra dell’elica possono essere mediati da una successione di diverse molecole di acqua e la spirale può quindi assumere una forma lievemente più stesa; al contrario, in carenza di umidità, quando si dice che il capello è secco, diminuisce il numero di molecole di acqua che fanno da ponte fra le terminazioni polari di una spira con l’altra, fino all’estremo in cui, per mantenere questi legami idrogeno in modo diretto, ovvero da un N-H ad un C=O della cheratina stessa, le spire si devono avvicinare notevolmente e quindi la spirale si comprime… e la fibra si accorcia. Con questo abbiamo spiegato la ragione delle variazione della lunghezza del capello con il variare dell’umidità.
Ed in qualche modo abbiamo anche giustificato la ragione per la quale i capelli non sufficientemente idratati risultano più crespi: fibre più corte e più irrigidite, meno libere di muoversi perché tenute insieme da legami idrogeno più diretti fra una spira e l’altra delle alfa-eliche, determinano in ultima analisi un capello più irrigidito, meno soggetto ad adagiarsi sotto l’effetto del suo stesso peso e comunque più difficilmente domabile sia dalla spazzola che dai prodotti cosmetici.
Per quanto riguarda il fattore di arricciamento in base all’umidità atmosferica, la questione è in realtà più complessa e va a toccare anche la natura delle forze secondarie che tengono insieme un’elica con un’altra, un protofilamento con un altro, e così via. Dobbiamo a questo punto considerare anche l’influenza dei gruppi R, finora taciuti, che fanno parte della struttura proteica e la caratterizzano (vedasi la prima schematizzazione del post).
La specifica tipologia di aminoacidi costituenti, determinando la natura esatta dei gruppi R che si innestano lungo la catena proteica, caratterizzano infatti alcune delle proprietà macroscopiche della cheratina: nel sistema di avvolgimento ad elica infatti, creandosi i legami fra i gruppo N-H e C=O definiti polari o “idrofili” (amici dell’acqua), ne consegue che i gruppi R, guarda caso piuttosto idro-repellenti o idrofobi, vengono spinti fuori e risultano esposti sulla parte più esterna della catena avvolta a spirale, ed infine anche sulla parte esterna delle fibrille di cheratina. Questo giustifica in primo luogo le ragioni per le quale le alfa-eliche si avvolgano a loro volta fra loro, e così anche le microfibrille e tutte le altre strutture più complesse delle quali ho parlato (si tratta di interazioni fra specifici gruppi R di alcuni degli aminoacidi costituenti), ma a livello più immediato questa disposizione dei gruppi idro-repellenti all’esterno delle fibrille giustifica anche il fatto che la cheratina sia altamente insolubile in acqua (ovvero i nostri capelli non si sciolgono mentre li laviamo!) e che trattenga poco l’acqua (e quindi sia possibile asciugarli relativamente in fretta).
In una situazione nella quale tutti gli avvolgimenti, dai protofilamenti alle microfibrille, stanno insieme per effetto idrofobo (ovvero modificando conformazione e legami nel tentativo di minimizzare il più possibile il contatto con l’acqua), la presenza di quantità in eccesso di molecole di acqua cambia in qualche modo, spesso non facilmente prevedibile e priori, l’assetto spaziale delle strutture coinvolte. L’introduzione di un eccesso di molecole di acqua fra le microstrutture longitudinali porta presumibilmente ad un certo ripiegamento delle microstrutture su se stesse, sempre nel tentativo di minimizzare il loro contrasto con l’acqua, e questo ripiegamento su larga scala si può tradurre in un arricciamento del capello.