Descrivere gli atomi senza ricorrere alle nozioni ed agli strumenti che la fisica e la matematica ci mettono a disposizione sembra a tutti gli effetti un’impresa difficile. Coloro che hanno tentato di farlo hanno seguito solitamente un approccio storico, che percorre le tappe della conoscenza dell’uomo attraverso le sue intuizioni, le sue osservazioni, le sue teorie e le sue scoperte. Il rischio in questo caso è però quello di imbottire ben bene il lettore di interpretazioni che, per quanto affascinanti, hanno ormai solo più valore sul piano storico, o al limite su quello dell’evoluzione del pensiero scientifico. Descrivere il “qui e adesso” della conoscenza sugli atomi senza fare uso di cognizioni fisiche superiori a quelle già in possesso all’uomo comune è a tutti gli effetti un’impresa difficile, che molti divulgatori probabilmente non vorrebbero affrontare per le insidie che obiettivamente racchiude. Insidie che derivano da un lato dallo scrupolo proprio degli uomini di scienza di pronunciare solo affermazioni ineccepibili nella loro correttezza formale, dall’altro dal fatto che una buona fetta della conoscenza che abbiamo degli atomi è in realtà così intrinsecamente distaccata dal mondo tangibile, quello per intenderci che siamo abituati a guardare e toccare, da obbligare il lettore ad un grosso sforzo di fiducia nei confronti dell’interlocutore. In primo luogo bisogna specificare che gli atomi esistono. Sembra un’affermazione da niente, ma l’umanità ha passato più di duemila anni a cercare prove della loro esistenza. Capita talvolta nella storia dell’uomo che l’intuizione filosofica precorra i tempi della scoperta scientifica, a volte di parecchi secoli. E’ capitato anche con la fisica quantistica, che come ci fa notare Fritjof Capra nel suo ormai famoso saggio “Il Tao della Fisica” è giunta ad una descrizione dei fondamenti ultimi della realtà sorprendentemente simile a quella che l’antica filosofia taoista cinese aveva già descritto quasi duemila anni prima.
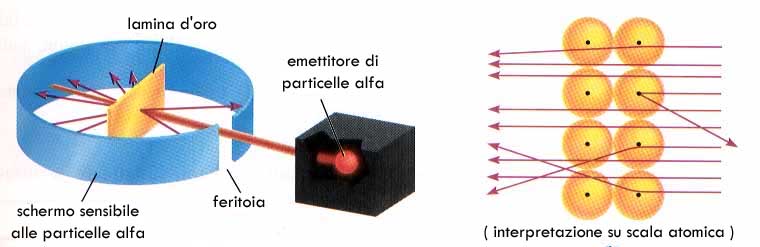
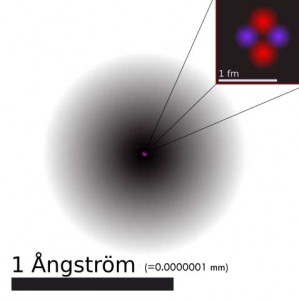
Ed è successo per gli atomi. Ipotizzati pur senza quelle che oggi definiremo “inconfutabili prove scientifiche”, in un’Atene del 4°-5° secolo a.C. che non aveva ancora visto la nascita dello stesso Socrate, tantomeno dell’alchimia che prenderà piede in europa non prima di un millennio più tardi, gli atomi intesi come “unità elementari costitutive della materia” sono stati inseguiti per secoli, soprattutto a partire dal XVII secolo, tanto che la dimostrazione relativa alla loro esistenza e la conoscenza della loro natura ha segnato la vita dei primi grandi chimici: da Lavoisier a Dalton, da Thomson a Rutheford, da Bohr a Scrodinger. Il concetto di atomo si contrappone a quello altrettanto filosofico di infinitesimo in quanto, a differenza di quest’ultimo, pone un limite alla suddivisione infinita della materia. Rimanendo nell’ambito chimico, l’atomo rappresenta l’unità fondante ed indivisibile della materia, il livello di organizzazione minimo possibile. E’ nota sì l’esistenza di particelle subatomiche (il protone, il neutrone e l’elettrone, ed inoltre particelle ancora più elementari che possono spiegare ulteriormente la natura di questi), ma tali particelle non godono delle proprietà che solitamente associamo alla materia tangibile, ad iniziare dal fatto che, almeno sul nostro pianeta, non possono esistere individualmente e conservativamente nel tempo al di fuori appunto della loro organizzazione nella struttura di un atomo. Mentre possiamo individuare una forte continuità fra le proprietà macroscopiche della materia e le molecole (o gli atomi) dalle quali essa è costituita, diversamente con le particelle subatomiche ci staccheremo in modo sostanziale da tutto questo, portandoci su un piano intangibile dove gli stessi termini di “massa” e “materia” assumono significati ben diversi da quelli che siamo soliti intendere. Lo stesso John Dalton, che aveva assistito all’isolamento di numerosi elementi al loro stato nativo (quindi non più impegnati in composti), primi fra tutti i metalli, definiva l’atomo come “la più piccola parte di un elemento che mantiene le caratteristiche fisiche di quell’elemento” L’atomo resta quindi l’unità minimale e fondante della materia, così come la intendiamo in riferimento alla nostra realtà macroscopica, alla nostra esistenza ed in generale a tutte le altre discipline scientifiche che fanno uso di questo concetto. Gli atomi sono immutabili ed indistruttibili …almeno finchè si resta nell’ambito della chimica. In analogia con lo stesso pensiero di Democrito, possiamo pensare agli atomi come ad entità fisiche immutabili, che non possono essere generate né distrutte. In qualsiasi reazione chimica gli atomi non si creano, non si distruggono e neppure si traformano (almeno per quanto riguarda i loro nuclei): quelle che si trasformano possono essere le molecole più complesse delle quali gli atomi possono fare parte e dalle quali si possono eventualmente staccare per riorganizzarsi in molecole di tipo differente. Gli stessi atomi, fisicamente “proprio loro”, individualmente, che costituiscono il corpo di ognuno di noi erano già presenti sulla terra milioni di anni fa, all’epoca dei dinosauri, e prima ancora quando il nostro pianeta non era altro che una massa di magma incandescente, e prima ancora quando la terra non esisteva, avendo essi un’origine ancora precedente. Ancora una volta la fisica nucleare sembra contraddire in parte questa definizione in quanto tutti gli atomi dell’universo sembrano essere stati di fatto “generati”, seppur in tempi antichissimi: più di 13 miliardi di anni fa nei primi tre minuti immediatamente successivi al Big-Bang (nucleosintesi degli elementi più leggeri) o in tempi appena poco più recenti, all’interno delle stelle (nucleosintesi stellare degli elementi più pesanti). Anche l’uomo con le reazioni nucleari ha imparato a “mutare” gli atomi l’uno nell’altro, a spezzare un atomo più grande in due più leggeri (fissione) o a fondere fra loro due atomi più leggeri per ottenerne uno più pesante (fusione), nonché a trasformare parte di un atomo in pura energia. Tuttavia lo stacco storico, tecnologico e concettuale fra il contesto delle reazioni nucleari e la chimica vera e propria, e con essa tutte le sue derivazioni nella realtà tangibile del nostro pianeta, nonché nella nostra condizioni biologica ed esperienza umana, fanno sì che possiamo ancora considerare gli atomi alla stregua di entità immutabili, che non possono essere né generate né distrutte. Gli atomi sono piccolissimi. Quella relativa alle loro dimensioni, per l’appunto estremamente ridotte e tali da non poter essere non soltanto visti, ma addirittura neppure “immaginati” dalla maggior parte di noi, è probabilmente una delle caratteristiche degli atomi più nota da parte dei non chimici. Il diametro degli atomi dei diversi elementi varia nel range di 0.5-6.0 Angstrom (ovvero da 0.0000005 mm a 0.00000060 mm). Per esempio l’atomo di ferro allo stato elementare, in pratica quello che possiamo trovare in un pezzo del comune metallo, ha un diametro di 2.54 Angstrom, ovvero 2.54E-7 (ovvero 0.000000254) mm. Intimamente connesso alle dimensioni vi è anche da considerare il fattore relativo al peso del singolo atomo. Per mettere in relazione il peso di una certa sostanza (sia allo stato elementare che organizzata in forma di molecole complesse) con il numero di atomi (o di molecole) in essa contenuti, e quindi per avere un’idea del peso del singolo atomo di quell’elemento, si ricorre al numero di Avogadro. Esso rappresenta in qualche modo la chiave di conversione fra il mondo macroscopico e quello microscopico, fra l’ordine di grandezza degli atomi (del loro peso individuale) e quello che risulta di fatto “pesabile” sul piatto di una comune bilancia di laboratorio. Il numero di Avogadro è il numero di atomi (o molecole) contenuti in “una mole” di sostanza, ovvero in una quantità in grammi di quella sostanza numericamente uguale al suo peso atomico (o molecolare), dato questo ricavabile tavola periodica degli elementi alla mano. In 55.845 g di ferro (1 mole) sono contenuti un numero di Avogadro di atomi di ferro, ovvero 6,022E+23 (cioè 602200000000000000000000) atomi. Come già ricordato, per quanto di dimensioni e di massa estremamente ridotte, gli atomi non possono essere considerati alla stregue di infinitesimi, nel senso filosofico o matematico del termine, in quanto godono pur sempre di dimensioni e di massa numericamente definite, ricavabili sperimentalmente ed univoche per lo stesso tipo di atomo. Gli atomi non si potranno mai vedere. E questa non è come molti potrebbero credere una limitazione derivante dall’inadeguatezza degli strumenti ottici disponibili, superabile quando (o se) si avranno a disposizione microscopi più potenti. Qui il problema sta a monte, nella definizione stessa del concetto di “vedere”, che nella sua accezione in senso stretto comporta necessariamente l’interazione fra la luce e l’oggetto esaminato. Il materiale di cui è fatto l’oggetto interagirà in modo differenziato con le diverse componenti dello spettro della radiazione visibile, in parte assorbendola, in parte restituendola (per riflessione o secondo altre modalità), manifestando di conseguenza quella proprietà esteriore nota come colore, consentendo comunque all’osservatore di ricostruire tramite il rapporto fra luce assorbita e riflessa punto per punto la forma dettagliata e la tessitura superficiale degli oggetti. Ma il problema qui sta appunto nelle definizioni. La luce non è un’entità adimensionale: la sua “lunghezza” d’onda è misurabile e, per quanto riguarda lo spettro della luce visibile, va da 380 nm a 750 nm, ovvero almeno tre ordini di grandezza al di sopra delle dimensioni atomiche. Quindi è come se volessimo misurare lo spessore di un foglio di carta velina avendo a disposizione solo un metro da sarta, uno di quelli che portano contrassegnati solo i centimetri. La luce visibile interagisce con lo strato elettronico esterno degli atomi del materiale esaminato, restituendoci l’eventuale colorazione di questo, oltre alla forma complessiva dell’oggetto di cui fa parte, ma immaginando di ingrandire indefinitamente l’oggetto fino a portarci teoricamente sulla scala degli atomi, non riusciremmo più a vedere nulla semplicemente perché, detto volgarmente, “non potremmo più vedere la luce”. Ci sono però altri modo per “vedere”, che non comportano l’uso degli occhi e neppure la necessità della luce: i ciechi percepiscono forme tridimensionali e tessiture delle superfici tramite il tatto, molti animali riescono a ricostruire anche spazialmente una realtà complessa intorno a loro semplicemente dall’odore che i corpi emettono, così come i pipistrelli nel loro volo notturno “vedono” l’ambiente che li circonda in funzione del ritorno degli ultrasuoni che loro stessi emettono, che può essere più o meno attutito o ritardato a seconda del tipo di oggetto che incontrano e soprattutto della sua lontananza. Ecco, se ammettiamo di poter utilizzare qualcosa di diverso dai nostri occhi, e quindi dalla luce, almeno quella intesa come visibile, possiamo “vedere” gli atomi attraverso diversi tipi di esperimenti. Al posto della luce possiamo utilizzare per esempio raggi alfa, che sono in pratica dei nuclei di elio, quindi carichi positivamente, come nel famoso esperimento di Ernest Rutheford del 1911.
In questo esperimento si direziona un fascio, in pratica un raggio concentrato e focalizzato, di particelle alfa attraverso una lamina d’oro talmente sottile da poter essere attraversata da queste particelle cariche. Dall’altra parte della lamina c’è un detector specifico, quello che potrebbe essere inteso come un occhio sensibile a questi raggi. Rutheford osservò che la stragrande maggioranza delle particelle non si spostava dalla sua traiettoria ed arrivava dritta dritta all’osservatore come fosse passata attraverso lo spazio vuoto, mentre solo una porzione molto piccola di esse subiva una forte deflessione, come se si scontrasse con qualche ostacolo in grado di deviarne la direzione rispetto a quella iniziale, prima dell’attraversamento della lamina d’oro. Questi ostacoli davvero minimali rispetto alla superficie della lamina erano i nuclei dell’oro, che di fatto costituivano gran parte della materia di cui erano fatti gli stessi atomi. Da questa fondamentale osservazione è derivata la sconvolgente scoperta che segue: Gli atomi sono principalmente spazio vuoto. Lo spazio compreso fra il nucleo e gli orbitali popolati dagli elettroni è essenzialmente spazio vuoto, o per lo meno vuoto di materia, mentre in compenso operano in esso campi di forza estremamente intensi dove si gioca l’attrazione elettrostatica fra il nucleo positivo e gli stessi elettroni, carichi negativamente, che non ricadono si di esso solo in funzione del loro moto estremamente rapido.
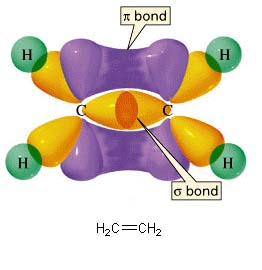
Questo spazio costituisce la stragrande maggioranza del volume occupato da un atomo, molto di più di quanto intuitivamente si potrebbe immaginare. Nei libri scolastici si vede disegnato talvolta un nucleo grosso come un bottone, con degli elettroni grandi come grani di pepe che gli orbitano intorno alla distanza di qualche centimetro. Ma le reali proporzioni del sistema-atomo sono in verità molto diverse: se il nucleo di un atomo avesse le dimensioni di una mela, gli elettroni ruoterebbero intorno ad esso alla distanza di circa un chilometro. Lo spazio compreso fra nucleo ed elettroni non può tuttavia essere occupato o attraversato da altra materia, e questo spiega la ragione per la quale pur essendo costituiti in gran parte da spazio vuoto, gli atomi non possono compenetrarsi reciprocamente, portando a conseguenze macroscopiche paradossali tipo la possibilità da parte degli oggetti di attraversare i muri di mattoni. Non vi è infatti solo la presenza di materia ad impedire il transito di ulteriore materia attraverso una porzione di spazio: si pensi ad esempio al campo repulsivo che un polo di una calamita crea intorno a sé nei confronti di una seconda calamita con la stessa carica. E’ quello che capita a due atomi che si avvicinano troppo: i due nuclei, entrambe con carica elettrica positiva, si respingono reciprocamente con forza. Gli atomi presentano una struttura modulare e prevedibile. Si tratta di entità strutturate in modo davvero complesso, a dispetto delle loro dimensioni e del fatto che, dal punto di vista della materia che entra a farne parte, questa consiste solo in tre tipi di particelle elementari: protoni, neutroni ed elettroni. Con queste tre particelle, in rapporti diversi e diversamente organizzate nello spazio e dal punto di vista energetico, sono costruiti tutti gli atomi esistenti, e di conseguenza tutte le molecole a loro volta fatte da atomi, fino alle loro organizzazioni più complesse di tipo biologico o geologico. La struttura del nucleo appare relativamente semplice, almeno ad un primo esame, con i suoi protoni (carichi positivamente) e neutroni (senza carica) appressati gli uni con gli altri, tenuti insieme da quella che i fisici definiscono “interazione nucleare forte”, una delle 4 forze fondamentali della natura (insieme all’interazione nucleare debole, all’elettromagnetismo ed alla gravità) Ben più complesso è il quadro della situazione relativamente agli elettroni, particelle cariche negativamente e di dimensioni e “peso” nettamente più piccoli di quelle dei protoni e dei neutroni (es. un elettrone pesa circa 1/10000 del peso di un protone). Da quando Rutheford verificò che gli elettroni, oltre a muoversi incessantemente, si collocano in zone periferiche dell’atomo, ad un’elevata distanza dal nucleo, sono stati proposti diversi modelli descrittivi dell’organizzazione elettronica dell’atomo.
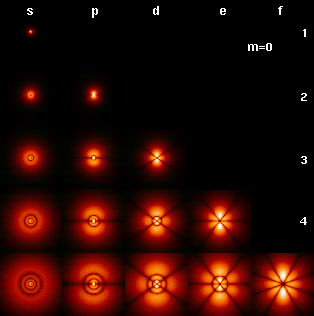
Tra questi modelli ormai superati il modello forse più noto, conosciuto come “planetario”, è entrato molto profondamente nel nostro immaginario, forse anche per responsabilità di un sistema scolastico che ha presentato come realtà ultime e finite quelle che in verità erano solo congetture di scienziati “al lavoro” in cerca di una risposta definitiva. Così profondamente che oggi risulta piuttosto difficile da scalzare nel nostro immaginario, sostituendolo con una rappresentazione che, anche se si è dimostrata più rispondente al vero, risulta sicuramente meno facile da visualizzare. Il modello a planetario creava una similitudine fra la struttura dell’atomo e quella del sistema solare, dove il sole rappresenta il nucleo ed i pianeti che descrivono orbite individuali di tipo ellittico, a distanze diverse e perfettamente definite nella loro traiettoria rispetto al sole, rappresentano gli elettroni. In realtà il lavoro di altri due ricercatori sempre della prima metà del ‘900, prima Niels Bohr e successivamente Erwin Schrodinger, ha portato ad un’evoluzione del modello atomico che di fatto non può più essere inteso nel senso deterministico e totalmente prevedibile descritto dal sistema planetario. In particolare non si dovrebbe più parlare di orbita elettronica alla stregua di una traiattoria, in quanto l’elettrone non compie di fatto un percorso preciso, ellittico o di altra forma, intorno al nucleo, ma piuttosto di orbitali, intesi come “gusci” elettronici che, racchiusi l’uno nell’altro, circondano il nucleo a diverse distanze. All’interno di un guscio l’elettrone si muove senza seguire un percorso preciso, ma rimanendo “all’incirca” nei pressi della superficie descritta dal guscio medesimo. Ogni orbitale corrisponde ad un livello di energia che caratterizza gli elettroni in esso contenuti: quelli più interni, più fortemente richiamati dalle cariche positive del nucleo, corrispondono ad energie minori (sono infatti questi ad essere occupati quando gli elettroni nell’atomo sono pochi) e contengono al tempo stesso meno elettroni, mentre man mano che ci si sposta su orbitali elettronici più esterni si assiste ad un aumento dell’energia associata agli elettroni in essi contenuti (che quindi potranno essere “scalzati” più facilmente dall’atomo ad opera di interventi esterni), ed al tempo stesso alla possibilità da parte degli stessi gusci esterni di contenere un numero maggiore di elettroni.
Ci viene inoltre riportato che in un atomo ogni singolo elettrone si trova di fatto in una situazione “personale” diversa, differenziandosi dagli altri per livello energetico, ed andando più sul fine per sottolivello sempre energetico (divisione più fine), dell’orientamento spaziale del suo guscio nel caso di una sua forma appena meno simmetrica di una sfera, ed infine del senso della sua rotazione su sé stesso. Ogni elettrone ruota infatti anche su sé stesso, e può farlo in senso orario o antiorario. Un’altra precisazione introdotta nei modelli atomici più attuali è il fatto che non possiamo individuare o prevedere la posizione esatta di un elettrone e al tempo stesso conoscerne con precisione il livello energetico: la sua localizzazione intorno all’atomo è di tipo probabilistico, ed un orbitale alla fin fine tende a rappresentare nient’altro che una superficie equi-probabilistica che unisce tutti i punti dello spazio tridimensionale intorno al nucleo dove gli elettroni in questione hanno il 95% di probabilità di essere presenti in quel momento. Questo spiega la forma di quegli orbitali dalla forma tanto fantasiosa che si vedono talvolta disegnati sui testi di chimica: accanto agli orbitali di tipo “s”, sferici, ne vengono infatti rappresentati altri di tipo “p” che hanno la forma di un 8, o altri più complessi ancora di tipo “d” ed “f”, con la forma di quadrifogli, di anelli concentrici o di fiori. L’orbitale disegnato rappresenterà la porzione di spazio intorno al nucleo dove la probabilità di trovare l’elettrone in questione è uguale o superiore al 95%. Dalla “configurazione elettronica” di un atomo, ovvero dalla esatta disposizione degli elettroni negli orbitali atomici, dipendono le più importanti caratteristiche dell’elemento che ne deriva: valenze possibili, reattività chimica e geometria delle molecole delle quali può entrare a fare parte.
Gli atomi esistono in un centinaio di tipologie diverse. Precisamente 82 diversi tipi di atomi (elementi) presenti in natura sul nostro pianeta e stabili nel tempo. A questi bisogna aggiungere una trentina di elementi, per lo più preparati artificialmente con reazioni di fusione nucleare (talvolta ritrovati in tracce in minerali spontaneamente radioattivi), di solito più pesanti e più instabili dei primi, alcuni dei quali possono esistere solo per brevi istanti prima di convertirsi negli atomi di altri elementi tramite reazioni nucleari spontanee, con relativa emissione di radiazioni.
La differenza fra un atomo ed un altro può essere relativa al diverso numero di protoni, di neutroni o di elettroni in esso contenuti, oppure di più di una di queste caratteristiche. Se la differenza è dovuta al numero di protoni gli atomi considerati rappresentano elementi chimici diversi. Il numero di protoni contenuti nel nucleo rappresenta il “numero atomico”, che è poi il criterio di ordinamento degli stessi elementi nella tavola periodica, è il fattore di base che pone la differenza fra un elemento ed un altro, creando i presupposti per gran parte delle proprietà specifiche di quell’elemento. Quando due atomi hanno lo stesso numero di protoni ma diverso numero di neutroni si tratta comunque dello stesso elemento, ma in aggiunta diciamo che i due atomi sono isotopi fra loro. La parola “isotopo” ha quindi esclusivamente il valore di aggettivo da utilizzare in un contesto di comparazione di almeno due atomi diversi. L’eventuale espressione “questo atomo (o questo elemento) è un isotopo” non ha quindi di per sé stessa nessun significato. Isotopi diversi dello stesso elemento chimico avranno proprietà chimiche pressoché identiche (ad esempio formeranno gli stessi composti che godranno dello stesso tipo di reattività chimica), mentre potranno variare anche in modo significativo le proprietà fisiche tanto degli elementi allo stato nativo che dei loro composti (ad esempio il loro peso specifico, il loro punto di ebollizione e di fusione, ecc), e questo in funzione del fatto che l’atomo di un isotopo con più elevato numero di neutroni peserà individualmente di più di uno con un numero di neutroni inferiore. Il numero risultante dalla somma del numero dei protoni e dei neutroni contenuti in un atomo prende il nome di numero di massa, mentre il peso atomico “assoluto” corrisponde alla sommatoria dei pesi reali di tutti i protoni e neutroni contenuti nell’atomo in questione. Alcuni elementi sono presenti in natura con un solo isotopo stabile (es. il fluoro), mentre altri elementi sono diffusi in natura con due o più isotopi ugualmente stabili (es. carbonio, idrogeno, cloro, ecc), anche se può capitare che uno degli isotopi risulti particolarmente raro rispetto all’altro. Ad esempio nel caso del carbonio esistono due isotopi stabili in natura: quello che contiene 6 protoni e 6 neutroni nel nucleo (il C12, più diffuso) e quello che contiene 6 protoni e 7 neutroni (C13, che costituisce solo 1,1% del carbonio totale del pianeta). Atomi con uguale numero di protoni e di neutroni ma diverso numero di elettroni (la differenza si gioca sempre negli orbitali energetici più esterni!) rappresentano stati di ossidazione differenti dello stesso elemento. Un concetto molto vicino a quelle che fino a qualche anno fa erano descritte come “valenze”. Il cromo con tutti i suoi 24 protoni e 24 elettroni, rappresenta lo stato elementare, con proprietà metalliche, dell’elemento; in seguito alla perdita di 3 elettroni esso si comporterà come catione metallico dotato di tre cariche positive, mentre in seguito alla perdita di 6 elettroni il risultante catione dotato di ben sei cariche elettriche positive tenderà ad organizzarsi con l’ossigeno per formare una specie anionica, il cromato, avente caratteristiche chimiche, fisiche e biologiche completamente diverse da quelle del cromo cationico. La variazione del numero di elettroni nei livelli energetici periferici di un atomo, a differenza di quelle relative al numero di protoni o neutroni, è oggetto di pertinenza della chimica ed in particolare della disciplina elettrochimica. Gli atomi (la maggior parte) hanno una forte tendenza a restare aggregati fra loro. E’ estremamente raro trovare in natura atomi isolati, che non risultino cioè aggregati con altri atomi dello stesso elemento, o ancora più facilmente che entrino a fare parte di molecole bi-, oligo- o poliatomiche.
I fenomeni che possiamo chiamare in causa per giustificare questo comportamento aggregativo sono numerosi e possono fare riferimento a fenomeni fisici anche molto diversi fra loro: l’unica caratteristica che li accomuna è la constatazione molto generale che in seguito all’aggregazione la materia sembra raggiungere per un motivo o per l’altro una condizione di stabilità maggiore, ovvero di minimizzazione energetica rispetto a quella che poteva caratterizzare inizialmente gli atomi isolati, come si sul dire “allo stato nativo”. Si va dalle forze più deboli, come le forze di Van der Waals che tengono vicini fra loro persino gli atomi dei gas nobili virtualmente incapaci di reagire chimicamente, ai legami metallici (validi sempre per elementi allo stato elementare, con elettroni esterni molto “mobili” che creano intorno alla moltitudine di nuclei una nube delocalizzata che in qualche modo li tiene uniti fra loro), ai legami covalenti (che prevedono la condivisione di elettroni fra due atomi che risultano pertanto legati fra loro), ai legami ionici (che prevedono prima una perdita di elettroni da parte di alcuni atomi e l’acquisto da parte di altri, con conseguente attrazione fra gli atomi carichi così generati), oltre ad alcune altre tipologie di legami, molto ben descritti all’inizio di ogni corso scolastico di chimica. Gli atomi non si possono maneggiare singolarmente. Questa constatazione mi è sovvenuta a dire il vero solo poco tempo fa, quando un conoscente veramente “a digiuno” in materia, vedendomi tracciare su carta delle reazioni chimiche con tanto di formule e simboli degli elementi, dove un certo atomo passava in seguito a reazione da una molecola ad un’altra, mi chiese “ma come fai a prendere e spostare un atomo?”. Ovviamente non con le pinzette. Pensiamoci un momento: ci sono almeno tre buone ragioni per le quali gli atomi non possono essere maneggiati singolarmente al pari dei componenti della minuteria da ferramenta come viti, dadi e bulloni. La prima ragione l’abbiamo detta: perché non si vedono, neppure con il migliore dei microscopi. La seconda è perché diventerebbe difficile anche soltanto poter immaginare una sorta di “pinzetta”, ovvero un microscopico strumento meccanico, adatta per compiere questa operazione: dovrebbe avere dimensioni all’incirca sulla stessa scala di quelle degli stessi atomi, con il problema che sarebbe costituita da atomi pure la pinzetta stessa! La terza ragione è perché ben raramente gli atomi se ne stanno isolati, da soli, staccati gli uni dagli altri, lasciandoci quindi la possibilità di operare sulla singola particella (vedi paragrafo precedente). Al contrario, per staccare atomi uniti fra loro da legami chimici sono spesso richieste energie straordinariamente elevate, specie se considerate in rapporto alle piccole dimensioni degli oggetti a cui si riferiscono. Di fatto il chimico non opererà mai sul singolo atomo, come neppure sulla singola molecola, bensì su una massa composta da un grandissimo numero di atomi o molecole dello stesso tipo, che come un gregge risponde alle stesse caratteristiche e si comporta nello stesso modo di fronte ad una sollecitazione esterna. Quando compie una reazione in provetta, il chimico opera su parecchi miliardi di atomi o di molecole, contemporaneamente e nello stesso modo.
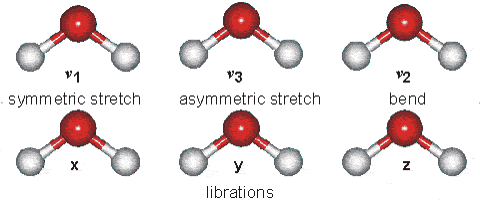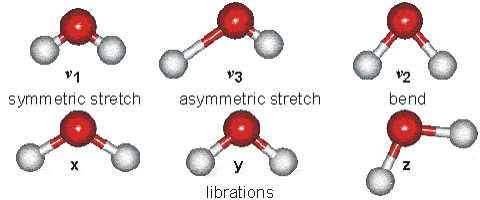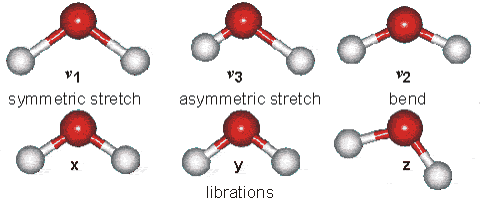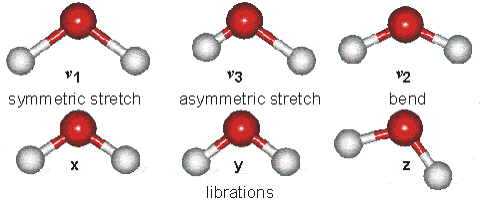
Tornando alla metafora dei pezzi da ferramenta, come ad esempio i bulloni, si immagini di avere bulloni sempre più piccoli: ad un certo punto avremmo difficoltà ad afferrarli con le dita per muoverli, poi anche semplicemente a vederli singolarmente, quindi potremmo avere bisogno di lente e pinzette per poter operare su di essi. Ma se la dimensione dei bulloncini dovesse diventare davvero minimale, al pari di una limatura di ferro, anche questi mezzi potrebbero risultare insufficienti. Ecco allora che potremmo pensare di spostarli in massa sfruttando una proprietà condivisa da ciascuna di queste particelle: quella di essere ferromagnetiche, quindi di poter essere attratte da un campo magnetico esterno. Operando con una calamita sotto il piano di lavoro tutti gli atomi seguiranno il suo movimento, dando all’operatore la possibilità di “prenderli e spostarli” in modo efficace, anche senza poterli vedere uno per uno. Il chimico nella sua attività lavora sugli atomi e sulle molecole in modo analogo, ragionando sul singolo ma operando sulla massa. Gli atomi non stanno mai fermi. Ma si muovono sia “al loro interno” che reciprocamente l’uno rispetto all’altro. Al loro interno vi è il noto movimento degli elettroni, che può essere paragonato ad una nuvola o ad uno sciame, o meglio ad un insieme di sciami concentrici, ciascuno diffuso ad una diversa distanza dal nucleo. Ma anche gli atomi nel loro insieme (nucleo + nuvola elettronica), comunemente impegnati tramite legami chimici nella struttura di una molecola, si muovono di un moto vibratorio intorno alla loro posizione di equilibrio, con frequenze sull’ordine delle decine o centinaia di THz (1THz equivale a mille miliardi di vibrazioni al secondo), in pratica nella zona dello spettro elettromagnetico corrispondente all’infrarosso. In verità queste vibrazioni non sono casuali ma seguono “modi” e regole ordinate che dipendono in primo luogo dal tipo di atomi (elementi) coinvolti, dalla natura del loro legame ed eventualmente anche dagli atomi legati in prossimità di essi. Queste modalità di vibrazione per esempio possono comportare un avvicinamento ed allontanamento degli atomi nella direzione del legame che li unisce (come fossero collegati con un elastico), ma anche un movimento perpendicolare a questo legame (quindi verso l’osservatore o in allontanamento da esso); se abbiamo un atomo che ne lega altri due, i due laterali si possono muovere rispetto a quello centrale come le ali di un gabbiano, come pure tutta la molecola nel suo insieme può spostarsi, ruotare nello spazio, ecc.
In un gas, anche in condizioni di perfetta quiete esteriore (es. dentro un contenitore immobile), gli atomi o le molecole si muovono molto rapidamente attraverso tutto il volume di spazio disponibile e finiscono per scontrarsi casualmente fra loro e contro le pareti stesse del contenitore. Queste vibrazioni atomiche si intensificano con l’aumentare della temperatura, mentre in prossimità dello zero assoluto esse diventano minimali (ma a quanto pare non scompaiono del tutto), dando l’idea di una sorta di “congelamento” nella posizione reciproca degli atomi. L’atomo in sé stesso è probabilmente più oggetto di interesse del fisico che non del chimico. La chimica si occupa del livello di organizzazione della materia che, partendo appunto dall’atomo, descrive, prevede e caratterizza i suoi stati aggregativi via via più complessi, costituiti da due, alcuni, diversi o moltissimi atomi, le molecole appunto, o anche gli ioni, i radicali… in pratica tutto cosa, con il massimo livello di generalizzazione possibile, viene oggi descritto come “specie chimica”. In verità le scoperte in campo chimico effettuate nella storia dell’uomo fino all’inizio del XX secolo ed in particolare subito prima, nel XIX secolo (metodi di sintesi inorganica ed organica, metodi di analisi, fino alla scoperta di nuovi elementi), sono state fatte tranquillamente senza conoscere davvero nulla della struttura dell’atomo.
Risulta essere vero che da quando questa conoscenza è entrata a far parte della comunità scientifica si è assistito ad un fiorire di nuovi metodi, tecnologie ed applicazioni che prendono le mosse proprio dalle scoperte relative alla struttura atomica e subatomica della materia, ma è altrettanto vero che queste tecnologie sono spesso concepite e sviluppate appunto più dal fisico che dal chimico, mentre quest’ultimo si trova a svolgere più il ruolo di utilizzatore e quindi di beneficiario della tecnica sviluppata. E’ un po’ come se gli atomi fossero i mattoni e le molecole il muro edificato con essi: un buon muratore conosce i suoi mattoni relativamente alle loro proprietà e caratteristiche, specifiche per ogni tipologia di mattone disponibile, li sa riconoscere e sa impiegarli al meglio, ma il suo scopo è comunque quello di “utilizzarli” per costruire un muro, ed è proprio in questo che consiste la sua arte ed il fulcro della sua competenza. Se non per curiosità, o perché intenzionato a cambiare mestiere, non sarà tenuto ad approfondire gli aspetti relativi a come i mattoni vengano fabbricati, quali ingredienti siano mescolati dal produttore ed in che rapporto reciproco, ed in generale tenderà a tralasciare tutta la loro storia precedente alla messa in commercio o le loro caratteristiche meno influenti sulla qualità del fabbricato: piuttosto, nel caso gli rimanesse del tempo a fine giornata, vorrà approfondire le tecniche costruttive al fine di realizzare muri più solidi, grandi e belli. Ed è anche un po’ questo il bello della chimica: il fatto che possa essere affrontata, è di fatto nei secoli lo è stata, sia come scienza esatta, basata su realtà fondanti, oggettive e prevedibili, che poggiano stabilmente le basi in un’altra disciplina (la fisica appunto), che come scienza empirica ma non per questo meno coerente al suo interno, dove le predizioni e le regole, anche quelle numeriche, possono essere ricavate per induzione o deduzione a partire dalla mole dei dati già osservati ed accumulati negli anni da altri ricercatori. E non si tratta solo di una differenziazione storica: ancora oggi, e non certo per ragioni di possibilità o di competenza, colleghi chimici che operano in campi di specializzazione differenti, o semplicemente lavorano su applicazioni diverse, magari nello stesso Ateneo o istituto di ricerca, si trovano a parlare in modo approfondito della struttura degli atomi oppure, semplicemente, si limitano ad utilizzarli.