Indice
Comincio con l’affermare che se nel mondo esistono industrie che producono cose utili (o nocive) per il genere umano, ciò è merito (o colpa) in gran parte del ferro e del carbonio. In pratica almeno l’80% dei metalli usati dall’uomo è strettamente imparentata con il sistema binario ferro/carbonio, e componenti ferrosi sono necessari per la produzione di altri tipi di materiali, dalle ceramiche ai polimeri, dai vetri ai compositi e agli elastomeri.
C’è da chiedersi il perché di questo situazione, e la risposta è una sola: combinando tra loro nel modo giusto quantità adeguate di ferro, di carbonio e di altri elementi chimici e sottoponendo i prodotti ottenuti (che sono “leghe”) a opportuni trattamenti termici e/o meccanici si può ottenere una vastissima gamma di proprietà tale da coprire le necessità dei più svariati campi della tecnologia. Il risultato può essere un metallo tenero e duttile da trasformare in un prodotto piano (lamiera) o in un tubo, oppure un metallo duro e fragile che serve per fare utensili utili per fabbricare altre cose. Può essere un prodotto che conduce bene o male il calore, per le applicazioni a cui servono tali proprietà. Si possono ottenere leghe adatte in impieghi in fonderia. E questo è un elenco assai limitato delle possibilità tecnologiche delle leghe ferrose. Rimane il problema fondamentale che è:
Come si produce l’acciaio
Ritengo importante premettere una considerazione fondamentale: la produzione dell’acciaio è in contemporanea un problema chimico, ecologico, economico e di qualità del prodotto finale. Preannuncio che, come si vedrà in seguito, in siderurgia avviene una infinità di reazioni chimiche di vario tipo, principalmente ossido-riduzioni ma anche reazioni di scambio. L’aspetto ecologico della produzione dell’acciaio è un grosso problema, in grado di condizionare le condizioni di vita delle popolazioni residenti in prossimità di quelle industrie siderurgiche che non pongono in essere adatti sistemi di controllo e di limitazione delle emissioni inquinanti (sistemi che oggi esistono!!!). Rilevantissimo è il problema economico: sul costo del prodotto finale quello della manodopera è un fattore secondario perché la voce principale è il costo dell’energia.
D’altronde vale anche l’affermazione che la qualità del prodotto è direttamente proporzionale a quanta energia è stata utilizzata per ottenerlo: lo indica il fatto che ancora oggi gli acciai qualitativamente migliori sono quelli prodotti nei paesi laddove ampia è la disponibilità di energia elettrica generata da fonti pulite (nel nord dell’Europa, ma anche in Austria, principalmente energia idroelettrica). Chi non ha questa disponibilità deve ricorrere ad altri sistemi che, in siderurgia, significa cercare di favorire le reazioni chimiche esotermiche a scapito di quelle endotermiche. Spero che queste poche righe abbiano svolto il compito di ribadire la strettissima connessione che in siderurgia esiste fra chimica, ecologia, economia e qualità.
Tornando al problema iniziale, si deve puntualizzare che l’uso del singolare nel chiedersi “come si produce l’acciaio” è chiaramente soltanto un problema lessicale, in quanto esistono migliaia di acciai, molti dei quali richiedono metodi di produzione specifici.
Materie prime siderurgiche
Subito una questione fondamentale, quella delle materie prime. Se si indicano come materie prime i minerali di ferro e il carbone, in pratica si fa riferimento ad una particolare metodologia di produzione dell’acciaio che si chiama “siderurgia a ciclo integrale” e implica l’uso di reattori dedicati, noti come altoforno e convertitore. In realtà esiste un metodo diverso che usa, in quantità prevalente, una “materia prima seconda” (non è un errore ma una giusta terminologia), cioè il rottame: la “siderurgia secondaria”, oggi chiamata anche “elettrica” poiché lo strumento utilizzato è il forno elettrico (prima era una semplice rifusione termica). Certo che per avere rottame occorre avere già fatto siderurgia integrale: quindi, in ultima analisi, non si sbaglia a pensare che tutto parte da prodotti naturali, cioè il minerale ferroso e il carbone fossile.
Ne risulta il seguente quadro. Il minerale ferroso è quasi sempre un ossido e, se non lo è, lo si fa diventare ossido mediante operazioni chimiche dette di “arrostimento”. Al carbone, oltre ad un compito di tipo termico, se ne attribuisce un altro detto “azione riducente”. Quindi il tutto parrebbe ridursi ad un semplice problema chimico: la riduzione degli ossidi di ferro con carbone. Ma in chimica le cose semplici sono rare, e la produzione dell’acciaio, come si vedrà, è una delle più complesse.
Risulta essere opportuno partire con alcune informazioni sulle materie prime, iniziando dai minerali ferrosi. Seguendo il criterio del tenore (in atomi) di ossigeno crescente, l’elenco degli ossidi di ferro naturali parte dalla wustite, a cui si attribuisce la formula FeO (nome chimico: ossido di ferro II o ossido ferroso), dove, teoricamente, vi è il 50% atomico di ossigeno. La wustite è rara, non ha interesse siderurgico e trova la sua collocazione soprattutto nelle collezioni mineralogiche. Segue la magnetite, Fe3O4 (ossido ferroso ferrico o, con nome in disuso, sesquiossido di ferro) avente in teoria il 57% atomico di ossigeno (le quantità teoriche in peso dei costituenti sono: 27,6% di ossigeno e 72,4% di ferro). Ovviamente i valori quantitativi reali sono inferiori ai teorici perché nelle miniere il minerale “fertile” è sempre accompagnato da una certa quantità di “ganga”, cioè di minerale di natura diversa da quella ricercata. La magnetite è il minerale ossidato di maggior importanza siderurgica perché, fra gli ossidi di ferro, è il più frequente in natura.
Al terzo posto fra gli ossidi di ferro si ha l’ematite, Fe2O3 (ossido di ferro III o ossido ferrico), dove in teoria l’ossigeno è pari al 60% atomico mentre il ferro vale il 69,9% in peso. Per ragioni energetiche (da spiegare in seguito) l’ematite sarebbe il minerale migliore in siderurgia, ma in natura è meno frequente della magnetite. Ovviamente per gli impieghi siderurgici sono utilizzabili anche minerali di ferro non ossidi, come il carbonato FeCO3 denominato siderite, e la limonite, un idrossido a cui si dà la formula Fe2O3.3 H2O. Quest’ultimo è il minerale ferroso più diffuso in natura, perché deriva dalla alterazione degli altri.
Non essendo ossidi, l’uso siderurgico di questi ultimi minerali è economicamente meno valido in quanto viene richiesto un surplus di energia per la loro decomposizione e trasformazione in ossidi. Lo stesso accade per il minerale ferroso forse più conosciuto, cioè la pirite, che è un disolfuro con formula FeS2. Anch’essa può venire arrostita a ossido con dispendio energetico ma il suo impiego in siderurgia è sconsigliato dalla presenza dello zolfo che risulterà essere un pericoloso inquinante per il prodotto finale: quindi è meglio usare la pirite per altri scopi come la produzione di acido solforico e, in caso di scarsità di minerale ossidato, utilizzare in siderurgia il sottoprodotto “cenere di pirite”.
Si può riportare una curiosità che è più di un aneddoto. In Toscana, e più precisamente nella zona di Piombino, nella seconda metà del XIX secolo nacque e si sviluppò un polo siderurgico autonomo. Si trattava delle attività industriali passate alla storia con i nomi di “Magona d’Italia” e “Ferriera Perseveranza” (non ho notizie sul perché di questi nomi). Per la produzione di acciaio in quelle industrie venivano utilizzati sia i minerali dell’isola d’Elba che una “materia prima seconda” di antica origine che ha avuto un ruolo importante nello sviluppo della siderurgia italiana: le “scorie etrusche” (Fig. 1).
Si tratta dei residui delle antiche operazioni siderurgiche eseguite da quegli ottimi metallurgisti che furono gli Etruschi. Le scorie etrusche erano particolarmente ricche in ferro e presenti in grande quantità in Toscana. Le industrie originarie hanno subito varie vicissitudini e variazioni di nome ma il polo metallurgico di Piombino, per la sua vicinanza al mare che è una via preferenziale per le importazioni di minerale, è ancora operativo anche se nell’Elba attualmente non ci sono più miniere attive e oramai è esaurita la disponibilità di scorie etrusche. Attualmente nelle aree di Populonia e di Baratti, vicino a Piombino, è attivo un turismo archeosiderurgico che suggerisce percorsi su colline che in realtà sono ciò che rimane degli originari cumuli di scorie etrusche.
Individuata la fonte di ferro, per produrre acciaio serve un agente riducente. Si sa che fin dall’antichità questo è stato identificato nel carbone. E per quasi 3000 anni, dall’inizio dell’età del ferro (circa 1200 a.C.) fino alla rivoluzione industriale inglese (circa 1700 d.C.), la fonte di carbone è stato il legno, con il conseguente processo di deforestazione di cui si sentono, ancora oggi, le conseguenze. Poi si è passati al carbone fossile, il cui impiego ha contribuito alla soluzione di alcuni problemi (ad esempio il maggior sviluppo di calore) ma ne ha generati altri (come ad esempio l’inquinamento da zolfo del prodotto finale).
C’è da chiedersi se, alla luce delle attuali conoscenze chimico-fisiche, il carbone rimanga ancora la soluzione ottimale; essendo in ballo considerazioni di tipo tecniche e industriali, per questa valutazione non si può prescindere da problematiche di tipo economico.
A livello industriale le reazioni chimiche devono essere veloci ed economiche. Veloce significa che la cinetica delle reazioni deve essere la più elevata possibile. Se si fa una classifica in funzione dello stato di aggregazione della materia, supponendo che ciò che si deve ridurre sia allo stato solido (in siderurgia il minerale di ferro), risulta che la cinetica è più elevata se il riducente è gassoso, diminuisce se il riducente è liquido, si minimizza se il riducente è solido. Quindi in siderurgia è preferibile un riducente gassoso, il quale deve essere anche economico e disponibile in quantità adeguata.
Quali sono le possibili alternative? Osservare la Tab. I.
Doverosamente, la scelta ricade sul carbonio, ottenuto dapprima come carbone da legna e poi dai carboni fossili. Il carbone da legna derivava dalla combustione in difetto di aria di cumuli di legno ricoperti di terra, le famose carbonaie, ora in disuso o usate per scopi non siderurgici (Fig. 2).
Il carbone fossile, prima di poter essere usato in siderurgia, viene trattato nelle cosiddette cokerie (Fig. 3) per ottenere quel prodotto noto come coke metallurgico. Il migliore è il litantrace a corta fiamma, un carbon fossile di età intermedia (quello un po’ più giovane si chiama lignite, quello più vecchio antracite) e con contenuto di sostanze volatili non troppo elevato che genera un coke con le caratteristiche chimiche e meccaniche ottimali per impieghi siderurgici.
Nella cokeria si esegue una operazione chiamata distillazione secca, che è un riscaldamento in assenza di aria del prodotto estratto in miniera (ovviamente, se ci fosse aria si otterrebbe cenere!): serve per eliminare tutte le componenti volatili (principalmente prodotti solforati e ammoniacali) o liquefabili (catrame). Ecologicamente, la cokeria è la parte più inquinante
Teoria della riduzione degli ossidi metallici con carbonio
Individuati i reagenti, ora entra in gioco la chimica! Considerando il coke come carbonio quasi puro, il riscaldamento in aria provoca la sua combustione secondo le seguenti note reazioni:
C + O2 → CO2 (1)
2C + O2 → 2CO (2)
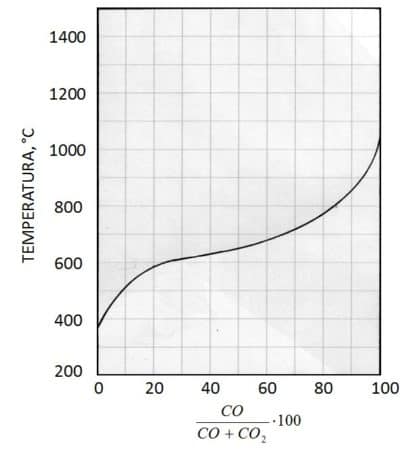
Come è stato dimostrato da Boudouard, ad ogni temperatura la reazione (3) raggiunge un equilibrio in corrispondenza di una precisa quantità relativa di reagenti e prodotti. In realtà l’equilibrio di Boudouard è influenzato anche dalla pressione, poiché C è una fase solida, mentre CO e CO2 sono gas: pertanto le moli gassose dei reagenti sono in numero diverso da quelle dei prodotti e ciò obbliga a definire un valore di riferimento per la pressione, ad esempio 1 atm (pari a 1.013 bar) o 1 bar (pari a 0.987 atm). Con queste premesse, Boudouard derivò la curva di equilibrio della reazione (3) ad ogni temperatura in funzione della percentuale di CO presente nella fase gassosa che è una miscela di CO e di CO2, cioè del rapporto:Ma se si opera con un eccesso di carbonio si ha anche la seguente reazione, nota come “equilibrio di Boudouard” :
C + CO2 ↔ 2CO (3)
che in siderurgia è di fondamentale importanza. La reazione (3) prende il nome dal chimico francese O. L. Boudouard (Fig. 3) che la studiò e pubblicò i suoi risultati nel 1905. Si tratta di una reazione di disproporzione (vecchia terminologia) o, meglio, una dismutazione, cioè un particolare tipo di ossidoriduzione interna: è come se, date due molecole di CO, considerate come reagenti, una si riduce a C mentre l’altra si ossida a CO2 (considerando C e CO2 come prodotti. Ovviamente si può considerare anche la reazione inversa, scambiando i vocaboli):
CO + CO ↔ C + CO2 (3bis)
CO/(CO+〖CO〗_2 ) 100
Ottenne la seguente curva, valida a 1 atm (se si varia la pressione la curva si sposta o verso l’alto o verso il basso):
Il campo del diagramma risulta diviso in due parti: se la coppia di valori di temperatura e composizione della fase gassosa identifica un punto al di sopra della curva, significa che nella miscela gassosa è presente una quantità di CO inferiore a quella di equilibrio e quindi in presenza di C la reazione (3) procede nella direzione:
C + CO2 → 2CO (3’)
aumentando la quantità di CO fino ad intersecare la curva e raggiungere la condizione di equilibrio. Al contrario, se la coppia di valori identifica un punto al sotto della curva, la miscela gassosa contiene più CO rispetto alla composizione di equilibrio e quindi la reazione procede nella direzione:
2CO → C + CO2 (3’’)
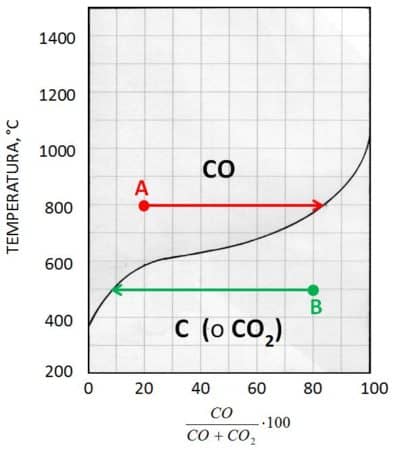
Ad esempio, se a 800 °C la miscela gassosa ne contiene il 20 % (punto A), dovrà prodursi CO secondo la (3’) fino a 82 % circa (Fig. 5, freccia rossa). Se a 500 °C la miscela gassosa ne contiene 80 % (punto B), la quantità di CO dovrà ridursi al 10 % secondo la (3’’)
Quanto sopra permette, convenzionalmente, di considerare il campo al di sopra della curva come quello di stabilità del CO, mentre la parte al di sotto della curva è il campo di stabilità di C (o di CO2).
Utilizzando lo schema proposto da Boudouard è possibile studiare e generalizzare le modalità di riduzione di un generico ossido MO per mezzo di CO. La reazione di riduzione:
MO + CO ↔ M + CO2 (4)
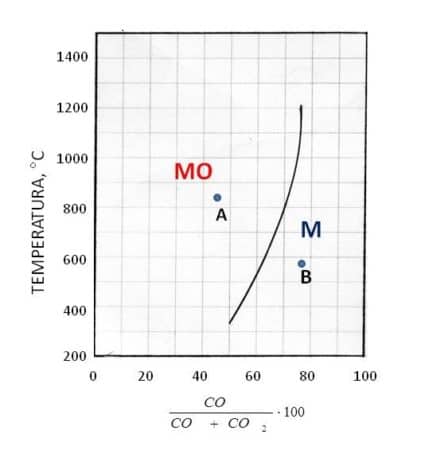
identifica una curva di equilibrio, ad esempio come quella in figura
Se il punto rappresentativo del sistema si trova a sinistra della curva (punto A) la quantità di CO nella miscela gassosa è inferiore a quella di equilibrio (e quella di CO2 in eccesso); pertanto, in presenza di M, la reazione procederà nella direzione:
M + CO2 → MO + CO (4’)
e invece della riduzione dell’ossido si ha la sua formazione. Se il punto rappresentativo del sistema è a destra della curva (punto B), nella miscela gassosa vi è un eccesso di CO rispetto all’equilibrio e in presenza di MO si ha:
MO + CO → M + CO2 (4’’)
con produzione del metallo M. Quindi la riduzione dell’ossido a metallo può avvenire soltanto se il sistema è a destra della curva. Quanto sopra permette di indicare il campo del diagramma a sinistra della curva come quello di stabilità di MO, mentre a destra della curva si localizza il campo di stabilità di M.
Sovrapponendo la curva di Boudouard vedi Fig. 4) a quella di riduzione del generico ossido metallico MO (vedi Fig. 6), il campo del diagramma risulta suddiviso in quattro parti, di solito chiamati quadranti (Fig. 7).
Supponendo che a 800 °C il sistema costituito da C, CO2 e MO sia nel punto A di Fig. 7, esso si evolve generando CO secondo la reazione:
C + CO2 → 2CO (3’)
e la % di CO nella miscela gassosa aumenta percorrendo il quadrante I fino a raggiungere la composizione del punto B. In tale condizione il CO prodotto da (3’) viene utilizzato da MO per attivare la reazione:
MO + CO → M + CO2 (4’’)
che implica la produzione del metallo M.
La reazione continua producendo M fino ad esaurimento della quantità di MO presente nel sistema. L’ulteriore presenza di C riattiva la reazione (3’) con produzione di CO, e viene percorso il quadrante II fino a raggiungere la composizione di equilibrio della reazione di Boudouard (punto C).
Nello stesso sistema chimico, ma a 600 °C (punto D), si attiva la reazione (3’) con formazione di CO fino al raggiungimento nella miscela gassosa la composizione di equilibrio secondo Boudouard, equivalente al punto E: la cinetica della reazione si arresta e, ovviamente, nel sistema chimico non si ha più alcuna variazione compositiva.
Supponiamo che a 500 °C la composizione della miscela gassosa corrisponda al punto F nel quadrante IV e che nel sistema chimico vi sia MO. La presenza di un eccesso di CO rispetto all’equilibrio fa sì che la reazione di Boudouard attiva sia:
2CO → C + CO2 (3’’)
e in contemporanea si abbia la riduzione di MO secondo la:
MO + CO → M + CO2 (4’’)
La quantità di CO diminuisce, fino a quando la composizione della miscela gassosa equivale al punto G. In tale condizione la reazione (4’’) è attiva fino ad esaurimento di MO mentre la (3’’) continua fino a raggiungere la composizione di equilibrio nel punto H.
In sintesi, se il sistema è nel quadrante IV, cioè a destra della curva di riduzione di MO e al di sotto della curva di Boudouard, si ha la produzione di M secondo la (4’’) e la formazione di C (quello che è noto come carbonio piroforico perché si infiamma immediatamente a contatto con l’aria) secondo la (3’’). Se il sistema è nel quadrante II, cioè a destra della curva di riduzione di MO e al di sopra della curva di Boudouard, le reazioni attive sono:
MO + CO → M + CO2 (4’’)
C + CO2 → 2CO (3’)
la cui somma vale:
MO + C → M + CO (5)
che giustifica la produzione del metallo ma è un’allucinazione chimica: per la (5) sembra che la riduzione sia dovuta a C, mentre il vero riducente è sempre CO gassoso! Ciò ha la seguente importante conseguenza: in pratica quando si deve attivare la riduzione non è necessario miscelare intimamente ossido e coke perché l’azione riducente è sempre svolta da una corrente gassosa di CO. Con riferimento al ruolo (vero o fittizio) svolto da C, si chiamano reazioni di riduzione diretta quelle del quadrante II, di riduzione indiretta quelle del quadrante IV.