Indice
Con davvero poca spesa, poca cultura chimica ed anche poco tempo a disposizione, sono molte le informazioni che possiamo ricavare su un campione incognito misurando in pochi istanti 3 parametri semplici semplici: grado brix, conduttività e pH.
Inutile dire che il campione deve essere liquido, e se è un solido deve essere solubile in acqua, perché quelle che ci apprestiamo ora a descrivere e quindi a misurare sono proprietà delle soluzioni, ed in particolare delle soluzioni acquose.
GRADO RIFRATTOMETRICO
Sul brix, più correttamente definito “grado rifrattometrico” ho già avuto modo di scrivere un intervento specifico alcuni mesi fa, al quale rimando per ogni approfondimento.
In questa sede riassumo semplicemente alcune informazioni generali.
Il grado brix si misura con un apparecchietto detto rifrattometro, disponibile sia nella versione tradizionale ottico-manuale (simile ad un piccolo canocchiale) che nella versione ottico-elettronica. Avete presente quando un oggetto immerso in parte in un liquido ma che emerge per l’altra parte, ad esempio un cucchiaino in un bicchiere d’acqua oppure una persona i piscina, sembra in qualche modo “spezzata”? E’ come se la linearità della parte immersa nel liquido formasse un angolo rispetto alla sua prosecuzione fuori dall’acqua. Ecco: questo angolo è detto angolo di rifrazione, ed il suo valore numerico è proporzionale alla concentrazione delle sostanze solide sciolte nella soluzione.
Quali sostanze? Potenzialmente tutte, inorganiche ed organiche, dagli zuccheri ai sali, dagli acidi organici alle proteine…
L’unità di misura adottata è il grado brix (°Bx) in onore del chimico francese Adolf Ferdinand Wenceslaus Brix e, nel caso del saccarosio per il quale è stato tarato inizialmente il metodo, 1 °Bx equivale “esattamente” all’1% p/p di saccarosio, ovvero ad 1 grammo di saccarosio per 100 g di soluzione acquosa.
Tradizionalmente la misura del grado rifrattometrico di una soluzione acquosa è adottata per valutare il grado zuccherino di uno sciroppo o di altri prodotti agro-alimentari ad elevato tenore zuccerino, come ad esempio un miele o un mosto d’uva. Sono infatti poche le analisi chimiche che con la stessa velocità, semplicità ed economicità ci possano fornire un responso relativo alla concentrazione di sostanze estremamente solubili, senza neppure richiedere una diluizione preliminare del campione. In pratica oggigiorno, con la spesa di poche decine di euro si può acquistare un apparecchietto elettronico che non coprirà sicuramente l’intera fascia da 0 a 99 brix e limiterà la risoluzione nel migliore dei casi ai primi decimali si mette una goccia del prodotto liquido su uno specchietto, si preme un pulsante ed ecco comparire su uno schermo digitale un valore di brix.
CONDUTTIVITA’
La conduttività misura invece la capacità di una soluzione di lasciarsi attraversare da una corrente elettrica, quindi di farsi essa stessa conduttore quando in essa siano immersi due contatti elettrici fra i quali sia stabilita una differenza di potenziale, come ad esempio il polo positivo e negativo di una pila. Con la conduttimetria saremo quindi in grado di misurare selettivamente la concentrazione dell’insieme delle sole specie chimiche in grado di contribuire a questa conduzione.
L’acqua al massimo grado di purezza, per intenderci quella perfettamente demineralizzata appena prodotta, conduce elettricità in modo del tutto trascurabile, ovvero mostra una notevole resistenza elettrica. Conducibilità (o conduttività) e resistenza (o resistività) elettrica sono infatti concetti inversamente proporzionali tra loro, se una soluzione ha elevata resistività significa che ha bassa conduttività, e viceversa.
La bassissima conduttività dell’acqua pura deriva in primo luogo dal fatto che essa non contiene alcuna specie chimica che possa svolgere la funzione di trasportatore di carica. A differenza di un conduttore metallico, dove gli elettroni sono liberi di circolare in una sorta di “spazio comune” e dove pertanto i nuovi elettroni che arrivano dal circuito elettrico sono in grado di spostarsi liberamente fino all’altro contatto, o se non altro di spingere al movimento altri elettroni indistinguibili da loro, in una soluzione acquosa non vi sono elettroni delocalizzati (ma sono tutti saldamente legati alla struttura molecolare dell’acqua stessa) e quelli nuovi che arrivano “restano a guardare” al termine del contatto elettrico immerso in essa, noto anche come elettrodo.
In realtà nelle soluzioni la corrente elettrica potrebbe essere trasportata, anche se non direttamente dagli elettroni, almeno da dei mediatori un po’ più grandi, gli ioni, che non sono altro che atomi o raggruppamenti di atomi con un’eccesso (quindi con carica negativa) o una carenza di elettroni (quindi con carica positiva), sempre presenti in quantità fra loro bilanciata.
Come noto, se applico una differenza di potenziale elettrico fra due elettrodi immersi in una soluzione contenente ioni, quelli di carica positiva (cationi) si muoveranno attraverso la soluzione spostandosi verso l’elettrodo negativo (catodo), mentre quelli carichi negativamente (anioni) si sposteranno in direzione opposta verso l’elettrodo positivo (anodo). Questa sorta di corrente ionica è il sistema attraverso il quale una corrente elettrica può attraversare una soluzione, e la soluzione in grado di mantenere questo fenomeno di trasporto si dice che conduce una corrente elettrica, ovvero semplificando è conduttiva, ovvero ancora offre poca resistenza al passaggio della corrente elettrica.
L’acqua pura conduce pochissimo, virtualmente nulla, l’elettricità semplicemente perché non contiene al suo interno ioni in grado di supportare questo tipo di conduzione. A dire il vero l’acqua va in contro, seppur nell’ordine di una molecola ogni 560000000, ad una divisione in una coppia costituita da un catione (H+) ed un anione (OH-) nota anche come auto-ionizzazione, ma l’entità di questo fenomeno è così ridotta che possiamo tranquillamente prendere questa conduttività di fondo dell’acqua come il nostro zero.
Gli strumenti per la misura della conduttività sono dei piccoli apparecchi elettronici, spesso in versione tascabile, provvisti di una sonda della dimensione di una pennarellone che deve essere immerso in parte nella soluzione in esame. All’interno della sonda è contenuta una cavità dove sono sistemati due contatti elettrici fra i quali esiste una differenza di potenziale elettrico, e la soluzione è libera di circolare liberamente fra i due. L’assetto geometrico della cavità e dei suoi elettrodi è tale da mantenere costante la superficie degli elettrodi e la loro distanza reciproca, in quanto solo annullando questi due fattori di variabilità, insieme a quello ambientale della temperatura della soluzione, è possibile individuare una relazione matematica secondo la quale la quantità di corrente elettrica che passerà fra i due elettrodi, chiudendo il circuito, sarà proporzionale alla capacità della soluzione di condurre la stessa.
La conduttività, più precisamente detta “conduttanza”, si misura in Siemens (S), un grandezza di preciso significato fisico ma di entità a dire il vero molto ampia, almeno per l’uso che sono soliti farne i chimici, che richiede solitamente in questo contesto il ricorso ai suoi sottomultipli mS (1/1000 di Siemens) e microS (1/1000000 di Siemenes).
Molti preferiscono utilizzare, con la medesima funzione, l’unità di misura reciproca della conduttività, ovvero la resistività, misurata in Homm (Ω): è facile passare da un’unità di misura all’altra ricordando che:
misura in Ω = 1 / misura in S
misura in S = 1 / misura in Ω
es. 15 mS = 0.015 S = 1/0.015 = 66 Ω
E’ anche vero che la conduttività specifica non è uguale per tutte le specie chimiche, per quanto di tipo ionico, ma dipende fra gli altri fattori dalla mobilità degli stessi ioni in ambiente acquoso, e quindi dal loro peso molecolare, dalla forma e dalle interazioni che sono in grado di stabilire con l’acqua o le altre molecole presenti in soluzione. In generale più è alta la mobilità di uno ione più in fretta esso sarà in grado di trasportare cariche elettriche (virtualmente elettroni) da un elettrodo all’altro: è in funzione di questo che le misure conduttimetriche possono essere utilizzate per valutare la concentrazione di un elettrolita (specie in grado di scomporsi in ioni) in soluzione solo conoscendo l’identità chimica dello stesso, o se non altro il valore numerico della cosiddetta “conduttività ionica equivalente”, che in pratica è una misura della conduttività di una specie chimica rapportata alla concentrazione (in equivalenti per cm3) della stessa, ovviamente mantenendo standard, e quindi matematicamente eliminando, l’influenza esercitata da tutti gli altri fattori, dalla geometria della cella alla temperatura.
pH
Tutt’altro discorso è quello che riguarda il pH. Si tratta del parametro di valutazione speditiva forse più conosciuto da parte dei non chimici, ma altrettanto frainteso. Con il pH noi andiamo a misurare la concentrazione degli ioni detti idrogenioni (H+), ovvero dei protoni virtualmente “liberi” in soluzione, tramite un elettrodo che non è altro che una sonda che attraverso un effetto elettrochimico produce una tensione elettrica che è proporzionale a questa concentrazione. Quando gli H+ in una soluzione superano in concentrazione gli OH- (si noti che siamo parlando delle due specie ioniche che insieme costituiscono l’acqua), è probabile che questi derivino non tanto dall’acqua stessa, quanto da molecole specificamente in grado di rilasciarli, ovvero da acidi (es. come l’acido cloridrico HCl). Quando sono gli OH- a prevalere, significa che essi sono generati direttamente o indirettamente dalla dissociazione di molecole definite basiche (es. idrossidi, come la soda caustica NaOH).
Il fatto che usualmente non esprimiamo direttamente la concentrazione di H+ ad esempio tramite una percentuale o una concentrazione molare deriva dall’elevatissima ampiezza del range all’interno del quale può variare la concentrazione degli H+. Parliamo infatti di almeno 14 ordini di grandezza fra le soluzioni acquose che contengono più idrogenioni e quelle che ne contengono meno; giusto per mostrare cosa significa tutto questo in termini di estensione numerica, come si può vedere nella tabella qui a fianco si passerebbe da 1 a 10000000000000.
Dai seguenti grafici si vede come tabulando una scala di numeri interi (il pH, appunto) contro la concentrazione di H+ espressa come molarità, si otterrebbe un curva che rapidamente inizierebbe a confondersi con lo zero.Questo renderebbe assai arduo organizzare strumenti con una scala di responsi così ampia, e la difficoltà riguarderebbe inoltre anche l’operatore che potrebbe domandarsi quanto variazioni numeriche che sulla carta sembrano ingenti possano di fatto influenzare le caratteristiche del prodotto.
In campo scientifico quando una variabile ha in come in questo caso un range di variabilità di diversi ordini di grandezza, si ricorre solitamente alla sua espressione in termini di logaritmo (quando tende a diventare molto piccola, ovvero al di sotto dell’1) o di esponenziale (quando tende a diventare molto grande). Sarebbe pertanto sbagliato affermare che una soluzione a pH 2 è il doppio più acida di una a pH 4. Quella a pH 2 infatti avrebbe una concentrazione di H+ pari a 0.01M, mentre una a pH sarebbe pari a H+ 0.0001.
Il rapporto fra 0.01M/0.0001 non + due (ovvero il doppio) bensì 100.
Quindi se volessimo stabilire “quanto la soluzione a pH 2 sia più acida di una a pH 4, sebbene personalmente sconsigli questo tipo di valutazione anche per il suo scarso e talvolta fuorviante significato pratico, potremmo dire che lo è di 100 volte!
Uno strumento di misurazione con una scala tradizionale, di tipo lineare come quella utilizzabile invece su rifrattometri e conduttivimetri, fornirebbe pertanto in questo caso valori che quasi sempre sarebbero confusi con una concentrazione pressoché nulla di H+!
Solo esprimendo la concentrazione di H+ sull’asse della ordinate (Y) come logaritmo decimale, si riesce a condensare tutto il range di 14 ordini di grandezza di escursione di questo parametro in pochi centimetri di grafico, restituendo una relazione rettilinea tra questo valore ed il pH
Formalmente il pH è infatti calcolato come il logaritmo in base 10 della concentrazione molare degli ioni H+, cambiato di segno (dal momento che il negativo di un numero molto piccolo, ovvero compreso fra 1 e 0, fornirebbe di per sé un valore negativo!), ovvero:
pH = -log[H+]
Se qualcuno per concludere dovesse domandarsi per quale ragione il range di pH vada proprio da 0 a 14, posso fugacemente ricordare che questi valori valgono in ambiente acquoso (quasi sempre il pH lo si esprime per soluzioni acquose) ed il range di contrazioni di H+ da cui questo range è derivato come inverso del logaritmo decimale, è una proprietà intrinseca dell’acqua in condizioni di temperatura ambientale standardizzata, essendo legato alle sue proprietà di “autoprotolisi”, ovvero di dissociazione spontanea in H+ e OH-.
In ultima analisi però sarebbe scorretto identificare nella pHmetria un metodo generale per la determinazione della concentrazione di un acido o di una base, almeno finchè non si conoscerà la reale identità chimica di questo acido, oppure di questa base. Un acido più debole ad elevata concentrazione può infatti impartire ad una soluzione acquosa lo stesso pH, o anche più alto, di un acido più forte ma più diluito. E’ anche vero che i pH estremi, altamente acidi o basici, registrati rispettivamente con un acido o una base forte anche discretamente diluiti, non potrebbero in nessun modo essere raggiunti con acidi e basi medi o deboli, ovvero non completamente dissociati in soluzione acquosa, quale che sia la loro concentrazione. La registrazione di un pH veramente estremo (es. pH<1-2 o pH>12-13) sono quindi indizi piuttosto chiari della presenza rispettivamente di acidi o basi forti in soluzione acquosa.
UTILIZZO COMBINATO DEI VALORI DI BRIX, CONDUTTIVITA’ E pH
Vediamo infine come la combinazione delle tre misure, realizzabile da ognuno di noi anche a livello domestico con un investimento non superiore ad un paio di centinaia di euro e senza particolari competenze scientifiche, possa aiutarci a comprendere qualcosa di più sulle caratteristiche composizionali delle sostanze che ci possono capitare fra le mani.
Innanzitutto bisogna specificare che i prodotti da testare devono essere allo stato di soluzione acquosa, quindi liquidi in base acqua, e se se tratta di prodotti allo stato solido, per esempio in polvere, questi devono essere preventivamente sciolti in acqua. Se essi all’atto pratico dovessero risultare insolubili in acqua non sarà possibile affrontare l’esame con le tre tecniche descritte ma la questione richiederebbe un approccio del tutto diverso, fuori dall’argomento di questo post. Ma immaginiamo per il momento di avere tra le mani delle soluzioni acquose o dei prodotti che possano comunque sciogliersi piuttosto bene in acqua. Anche se potrebbe risultare scontato, ricordo per inciso che l’acqua da utilizzare per questo tipo di soluzioni deve essere di tipo demineralizzato, o anche semplicemente purificata per distillazione.
Per iniziare, possiamo prendere in esame i differenti significati che potrebbe assumere la lettura strumentale di un ipotetico “valore zero” misurato presumibilmente su tre soluzioni acquose differenti rispettivamente da un rifrattometro, da un conduttivimetro e da un pHmetro.
Un brix pari a zero nella maggior parte dei casi si riferisce ad acqua pura o a concentrazioni di soluti solidi generici inferiori al limite di rilevabilità dello strumento.
Per via delle diverse sensibilità delle tre tecniche di indagine (la rifrattometria è la meno sensibile, la conduttimetria è intermedia, mentre la pH-metria è influenzata da concentrazioni di acidi o basi forti ancora inferiori), una soluzione sulla quale il nostro rifrattometro portatile mostrasse brix pari a zero potrebbe in realtà mostrare un valore di conduttività non proprio nullo, anche se probabilmente non molto elevato, e soprattutto un pH che potrebbe anche essere sensibilmente diverso dal valore di neutralità pari a sette.
Una conduttività pari a zero, o comunque al limite del rumore dello strumento, è indice di acqua purissima almeno dal punto di vista ionico, ovvero completamente priva di sali minerali, come ad esempio l’acqua distillata o sottoposta a trattamento di demineralizzazione su resine scambiatrici di ioni.
E’ da sottolineare però che anche un solvente non ionico, ad esempio l’alcol etilico, fornirebbe se puro un responso conduttimetrico teoricamente nullo in quanto non consentirebbe neppure lui di supportare la conduzione elettrica, quindi paradossalmente la conduttimetria non sarebbe in grado di dirci se il materiale liquido che stiamo esaminando sia acqua pura o alcol etilico puro, ed inoltre in caso di soluzione acquosa risulterebbe del tutto cieca nei confronti dei soluti non ionici, per esempio nei confronti dei carboidrati e della maggior parte delle sostanze organiche idrosolubili, che solitamente hanno caratteristiche di polarità (indispensabili per potersi sciogliere in acqua) senza per questo avere la possibilità di scindersi in ioni.
Un pH pari a zero indica una soluzione estremamente acida, contenente presumibilmente un acido minerale forte (es. cloridrico, nitrico, solforico, ecc) in elevate concentrazioni (1M, che per l’acido cloridrico significa per esempio 3.6% in peso). Un acido in genere è anche in grado di influenzare il responso della conduttività in quanto si tratta pur sempre di una sostanza ionica, tuttavia se l’acido è veramente molto forte vedremmo che concentrazioni anche minimali di esso sono in grado di abbassare drasticamente il pH, mentre il responso conduttimetrico potrebbe spostarsi solo di poco dallo zero strumentale.
Finalmente possiamo ora passare ad esaminare i casi più complessi, quelli che davvero descrivono situazioni autentiche e reali, tratti dalla vita di tutti i giorni, dove non la singola ma tutte e tre le misurazioni, considerate nel loro insieme, possono fornirci informazioni preziose su alcuni aspetti composizionali dei nostri prodotti:
Un pH molto alto (es. maggiore di 12, ovvero basico) se associato ad un ridotto grado rifrattometrico (es. 0.30) e ad una ridotta conduttività (es. 0.5mS) potrebbe indicare la presenza di sostanze in bassissima concentrazione a fortemente alcaline, ad esempio della soda caustica (idrossido di sodio, NaOH) o del sapone tradizionale tipo Marsiglia.
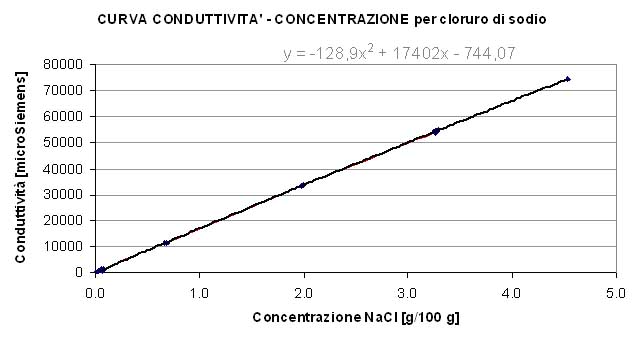
Un grado rifrattometrico elevato, associato ad una conduttività elevata ma un pH non molto diverso da pH 7 (neutralità) potrebbe indicare la presenza di concentrazioni elevate di sali in soluzione, ed in particolare di sali neutri come in cloruro di sodio, il comune sale da cucina.
Un grado rifrattometrico elevato, associato ad una conduttività ridottissima e ad un pH prossimo alla neutralità potrebbe suggerirci di essere in presenza di uno sciroppo zuccherino.
Un pH ridotto (es. 3.5, ovvero debolmente acido) se associato ad un grado rifrattometrico modesto e ad una conduttività molto elevata potrebbe suggerirci di trovarci di fronte ad un acido debole ad elevate concentrazioni, ad esempio rimanendo in ambito delle sostanze naturali ed alimentari ad un aceto.
Una conduttività “relativamente” elevata, a fronte di un grado rifrattometrico pressoché zero ed un pH solo debolmente acido potrebbe suggerirci l’idea che la soluzione sia composta essenzialmente da acqua, che ha assorbito con il tempo quantità abbondanti di anidride carbonica dall’atmosfera o nella quale lo stesso gas è stato introdotto artificialmente (es. acqua gassata in bottiglia): l’anidride carbonica sciolta nell’acqua si converte infatti in buona parte in acido carbonico, un acido molto debole che incide poco sul valore di pH (che infatti si abbasserà solo lievemente rispetto al valore di 7 dell’acqua pura) ed ancor meno sul valore rifrattometrico, che potrebbe continuare ad essere letto come zero con la maggior parte degli strumenti commerciali. Al contrario, dissociandosi almeno in parte in soluzione acquosa in ioni di carica opposta, l’acido carbonico è in grado di mantenere una certa conduttività elettrica della soluzione. Questo spiega anche il fenomeno per mezzo del quale se lasciano immersa una sonda conduttimetria in acqua demineralizzata appena prodotta e lasciata liberamente a contatto con l’aria, il valore della conduttività misurato, inizialmente approssimabile con lo zero, tenderà ad aumentare nel tempo.
Inutile ricordare come questo sistema ternario di valutazioni, per quanto economico, speditivo e di facile impiego, non rappresenti che il primo, anzi il primissimo passo verso la conoscenza delle nostre soluzioni.
Le prime due limitazioni che vengono a galla sono probabilmente quella della non descrittività delle specifiche sostanze chimiche presenti nella soluzione e della difficile interpretazione dei responsi qualora in soluzione fossero presenti contemporaneamente più specie chimiche diverse (i cosiddetti miscugli).
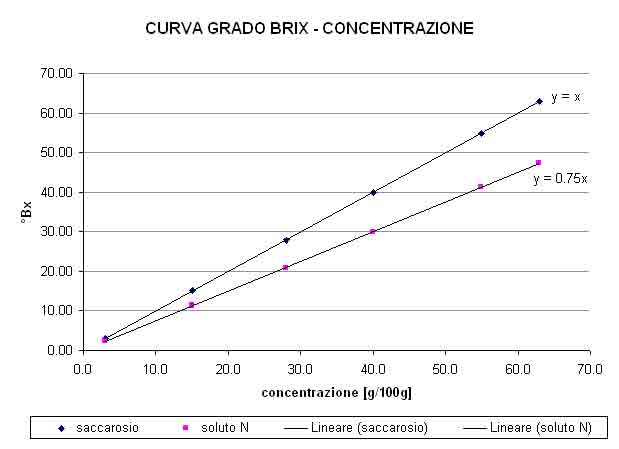
E’ facilmente intuibile, per esempio, come una soluzione acquosa contenente sia zuccheri che sali non sia immediatamente svelabile con questo sistema: la conduttività potrebbe indicarci che c’è qualcosa di ionico in soluzione (ed il pH neutro potrebbe eventualmente confermarci che non si tratta di un acido o di alcali, bensì di un sale): sperimentalmente potremmo pertanto provare a diluire del sale a diverse concentrazioni, misurando conduttività e brix delle soluzioni ottenute e confrontando queste coppie di valori con quella di conduttività e brix riferita al nostro campione incognito. Se a parità di conduttività, il grado rifratto metrico dei campioni sperimentali resta più basso, è probabile che nel campione incognito ci fosse “qualcos’altro” a tenere alto il brix, qualcosa che non aveva influenza sulla conduttività, ovvero nel più comune dei casi uno zucchero.

In casi poco meno che banali, dove il sospetto che le sostanze chimiche contenute nel campione siano più di una, l’incrocio dei responsi di queste tre misure speditive, seppur prezioso come inizio, dovrà necessariamente essere integrato con tecniche di analisi propriamente dette, in grado di identificare e quantificare le concentrazioni delle varie specie chimiche contenute nel campione.
Allo stesso modo dovremmo forse imparare, o meglio “reimparare” anche noi chimici moderni, prendendo insegnamento dai nostri nonni scienziati, che quando ci viene portato a “chimicare” un campione acquoso completamente incognito, prima, molto prima di introdurlo in un sofisticato HPLC, magari abbinato ad uno spettrometro di massa, rischiando magari pure di danneggiare questi delicati strumenti, oppure di sottoporlo a spettroscopia NMR o IR o quant’altro, dovremmo forse iniziare a ragionare banalmente sui suoi valori di brix, conduttività e pH.