Indice
In questa guida spieghiamo cosa cono le soluzioni tampone e come si preparano.
Che cosa sono
Per soluzione tampone si intende una soluzione acquosa in grado di mantenere pressoché inalterato il proprio pH, in seguito all’aggiunta di moderate quantità di acidi o basi forti, o rispetto alla diluizione della soluzione stessa.
Hanno potere tampone le soluzioni contenenti
-un acido debole e il suo sale con una base forte;
-una base debole e il suo sale con un acido forte.
In sostanza, definendole nell’ottica della teoria di Bronsted e Lowry, le soluzioni tampone sono costituite da una coppia acido-base coniugata debole.
Come si preparano
Una soluzione tampone può essere preparata in due modi diversi
-Aggiungendo direttamente alla soluzione l’acido (o la base) debole e il suo sale. Per esempio: acido acetico e acetato di sodio, oppure ammoniaca e cloruro di ammonio.
-Aggiungendo l’acido (o la base) debole e una base (o un acido) forte. Per esempio: acido acetico e NaOH, oppure ammoniaca e HCl.
Nel primo caso, le concentrazioni dell’acido e della base coniugata sono immediatamente note, essendo equivalenti alle concentrazioni analitiche dell’acido e del sale.
Nel secondo caso queste dovranno essere ricalcolate attraverso la stechiometria della reazione (a completamento):
![]()
In cui HA indica l’acido debole, OH- la base forte e A- la base coniugata dell’acido.
Per esempio, se la C°a è 0.1M e la C° NaOH è 0.05M, dopo la reazione avremo in soluzione
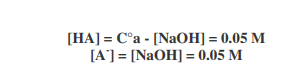
Poiché la [H+] in una soluzione tampone è data da

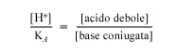
la scelta della coppia acido-base adeguata a “tamponare” ad un determinato pH deve essere fatta in funzione della Ka dell’acido.
Si noti che la 1.1 può essere utilizzata per qualsiasi soluzione tampone, indipendentemente da come è stata ottenuta o da come la si descriva: in una soluzione tampone si ha infatti sempre una coppia-acido base coniugata. In altri termini, anche il pH di una soluzione preparata da ammoniaca e cloruro di ammonio si può calcolare con l’equazione 1.1. In tal caso, l’acido è lo ione ammonio e la base coniugata l’ammoniaca; la Ka è ovviamente quella dello ione ammonio, pari a Kw/Kb dell’ammoniaca.
Come funzionano
L’uso di un esempio concreto, faciliterà sicuramente la comprensione del funzionamento di una soluzione tampone. Supponiamo di avere preparato una soluzione contenente acido acetico e ioni acetato nella stessa concentrazione: 0.1 M. Consideriamo l’equilibrio acido-base esistente in soluzione
![]()
Poiché la concentrazione dell’acido acetico è uguale a quella dell’acetato, la [H+] = Ka dell’acido (vedi 1.1) e pH = pKa (ovvero 4.74).
Se aggiungiamo un acido forte, ad esempio HCl, ad una concentrazione 0.01 M, questo reagirà con gli ioni acetato secondo la reazione
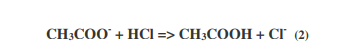
L’acido aggiunto è quindi completamente “neutralizzato” dagli ioni acetato, presenti in largo eccesso rispetto all’HCl, e si forma una quantità di acido acetico (e di ioni cloruro) pari alla quantità di HCl aggiunto. Ma di quanto è cambiato il pH? Se avessimo aggiunto la stessa quantità di acido cloridrico all’acqua pura, avremmo risposto prontamente che il pH sarebbe sceso da 7 a 2.
E nella soluzione acido acetico-acetato?
La risposta non è ovviamente altrettanto immediata: occorre prima ricalcolare le concentrazioni dell’acido acetico e dell’acetato. In pratica, è come se si trattasse di una titolazione di una base debole con un acido forte. Abbiamo già osservato che si forma una quantità stechiometrica dell’acido debole, che diventa pertanto 0.1 + 0.01 = 0.11 M. La concentrazione dell’acetato si riduce invece di una quantità pari alla concentrazione dell’acido forte aggiunto: 0.1 – 0.01 = 0.09 M. A questo punto è possibile utilizzare la 1.1 per calcolare la [H+], che risulta 2.2 x 10-5 M, da cui pH = 4.66. Ovvero, appena 0.08 unità in meno di quello iniziale.
Se aggiungiamo invece una base forte, ad esempio NaOH, ad una concentrazione di 0.01 M, questa reagirà con l’acido acetico secondo la reazione
![]()
Il risultato è perfettamente “speculare” al caso dell’aggiunta dell’acido forte: la base aggiunta è totalmente “neutralizzata” dall’acido acetico, la cui concentrazione si riduce a 0.1 – 0.01 = 0.09 M; la concentrazione dell’acetato sale invece a 0.1 + 0.01 = 0.11 M. La [H+] diventa 1.47 x 10-5 e il pH 4.83 (0.09 unità in più rispetto a quello iniziale). Se avessimo aggiunto la stessa quantità della base forte all’acqua pura, il pH sarebbe salito da 7 a 9.
Potere Tampone
Fino a che punto una soluzione tampone può opporsi a variazioni della propria concentrazione idrogenionica in seguito all’aggiunta di acidi o basi forti? E da cosa dipende questa capacità, il suo potere tampone?
Daremo subito una risposta al secondo interrogativo e successivamente cercheremo di sostenere la validità delle due preposizioni che seguono, rispondendo così, più o meno indirettamente, anche al primo quesito.
Il potere tampone di una soluzione dipende
-dalla sua concentrazione;
-dal rapporto tra le concentrazioni della coppia acido-base coniugata
Quantitativamente, possiamo esprimere il potere tampone di una soluzione in due modi alternativi, sebbene strettamente correlati. Ovvero, come:
-L’entità della variazione del pH della soluzione in funzione dell’aggiunta di una quantità fissa, arbitraria di un acido o una base forte.
-Gli equivalenti di acido o base forte che, aggiunti a 1 litro di soluzione, ne fanno variare il pH di 1 unità. La seconda definizione è più rigorosa, ed è quella che utilizzeremo
Potere tampone e concentrazione
Tenendo presente il meccanismo attraverso il quale la soluzione tampone agisce, è intuitivo concludere che maggiore è la concentrazione della coppia acido-base coniugata, maggiore è la quantità di acido o base forte che può essere aggiunta senza provocare “importanti” variazioni del pH. Per esempio, se a 1 litro della soluzione acido acetico – acetato, entrambi 0.1 M, si aggiungono 0.1 moli di HCl, l’acetato presente viene totalmente “protonato” dall’acido forte e il pH, da 4.74, scende a 2.72 (la [acido acetico] diventa infatti 0.2 M). Se invece aggiungiamo la stessa quantità di HCl a 1 litro della stessa soluzione 10 volte più concentrata, il pH passa da 4.74 a 4.66. Il potere tampone è quindi direttamente proporzionale alla concentrazione della soluzione.
Potere tampone e rapporto acido : base coniugata
Il potere tampone di una soluzione è massimo quando la [acido debole] = [base coniugata]. Ovvero, quando il loro rapporto è 1:1. Valuteremo quantitativamente, attraverso la definizione data al punto 2, la variazione del potere tampone della soluzione acido acetico – acetato (0.1 + 0.1 M), al variare del rapporto di concentrazione della coppia acido-base coniugata. Dobbiamo quindi calcolare quanti equivalenti di acido forte, ad esempio HCl, si devono aggiungere a 1 litro della soluzione per abbassare il pH di 1 unità. Il pH iniziale è 4.74; quanti equivalenti di HCl occorrono per portarlo a 3.74? È necessario fare in modo che il rapporto fra la coppia acido-base coniugata sia tale da soddisfare l’equazione

Data la stechiometria della reazione (2), dobbiamo risolvere l’equazione: ([acido debole] + [HCl]) / ([base coniugata] – [HCl]) = 10 Posto [HCl] = x, abbiamo che (0.1 + x) / (0.1 – x) = 10, da cui x = 0.082 eq./litro. 0.082 è quindi il potere tampone della nostra soluzione.
Nella “nuova” situazione, la soluzione ha ancora lo stesso potere tampone? Una risposta quantitativa a questo interrogativo non è certamente immediata, ma la risposta qualitativa dovrà essere pronta: “No, il potere tampone è diminuito.” Vedremo poco più avanti che il potere tampone, oltre ad essere diminuito, è diverso nei confronti di un acido o di una base, essendo diverso il rapporto di concentrazioni dell’acido e della base coniugata. Per il momento limitiamoci a calcolare il “nuovo” potere tampone, nei confronti di un acido forte.
Nella “nostra” soluzione, la concentrazione dell’acido acetico è ora 0.182 M, quella dell’acetato 0.0182; il rapporto [acido]/[base] è 10 e il pH 3.74. La domanda è quindi: quanti equivalenti di HCl si devono aggiungere a 1 litro per portare il pH a 2.74?.
Ripetiamo esattamente il calcolo fatto in precedenza e troviamo che il rapporto [acido]/[base] deve essere 100. Posto [HCl] = x, da (0.182 + x) / (0.0182 – x) = 100, si ricava che x = 0.016 eq./litro: il potere tampone si è ridotto a circa un quinto di quello iniziale.
Se ripetessimo nuovamente il calcolo, troveremmo che a questo punto il potere tampone si è ulteriormente ridotto ad un decimo del precedente: un cinquantesimo di quello iniziale.
Facciamo adesso un passo indietro e calcoliamo invece il potere tampone della soluzione a pH 3.74, nei confronti di una base forte. Un semplice calcolo, se mai ce ne fosse bisogno, ci dice che per portare il pH a 4.74 sono necessari 0.082 eq./litro di NaOH. Ovvero il potere tampone nei confronti di una base è cinque volte quello nei confronti dell’acido.
Limite funzionale di una soluzione tampone
Normalmente, l’intervallo “efficace” di una soluzione tampone si considera compreso tra pKa ± 1. Ciò corrisponde ad un rapporto fra [acido debole] e [base coniugata] compreso fra 0.1 e 10. Tuttavia, anche entro limiti compresi fra 0.05 e 20, o anche leggermente più ampi se la soluzione è abbastanza concentrata, il tampone conserva una certa efficienza. Quindi il limite funzionale può essere considerato compreso fra pKa ± 1.4
A cosa servono
Nella sperimentazione biochimica, l’impiego delle soluzioni tampone è routinario: non vi è praticamente tecnica che non ne faccia uso. Molte molecole biologiche sono particolarmente sensibili al pH del mezzo, sia per quanto riguarda la loro attività, sia la loro stabilità. Velocità di reazione e equilibrio chimico dipendono spesso dal pH. L’attività degli enzimi si esplica quasi sempre entro limiti di pH molto ristretti (pH ottimale); il pH ha inoltre un effetto diretto sulla ionizzazione di molti substrati o può addirittura compromettere la stabilità stessa dell’enzima. Tuttavia, qualcuno potrebbe a questo punto contestare la necessità di ricorrere all’uso di soluzioni tampone, se lo scopo è solo quello di avere soluzioni a un particolare pH. Ovviamente il ricorso alle soluzioni tampone è motivato dall’esigenza primaria di mantenere il valore del pH entro ben determinati limiti. In modo quindi da cautelarsi contro possibili variazioni del pH causate dall’aggiunta al sistema in esame di sostanze con proprietà acido-base più o meno spiccate, oppure dovute all’attività stessa dei componenti del sistema. Infatti, nel corso di una reazione enzimatica si possono verificare variazioni della concentrazione idrogenionica della miscela di reazione, come avviene ad esempio nel caso delle reazioni catalizzate dalle deidrogenasi piridiniche, in cui il coenzima (NAD) “rilascia” uno ione H+ per ogni coppia di idrogeni rimossi dal substrato.