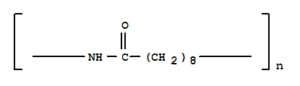Leo Baeckeland nel 1907 inventò il primo materiale polimerico di sintesi, la resina fenolo-formaldeide battezzata (con molta modestia!) ‘Bachelite’; si tratta di un polimero termoindurente in cui le catene sono legate in una struttura a rete. Tuttavia, ancora non vi era consapevolezza della natura macromolecolare del materiale prodotto: il concetto di macromolecola fu introdotta solo trent’anni dopo grazie all’opera di Hermann Staudinger in Germania e Wallace Carothers in America.
Fino al 1920 per spiegare l’alto peso molecolare dei polimeri naturali e di sintesi era in auge la ‘Teoria micellare’, sviluppata da Graham e Ostwald che ipotizzava l’esistenza dei ‘colloidi’, aggregati di molecole a basso peso molecolare tenute insieme da deboli forze di non-legame (aggregati supramolecolari, diremmo oggi), in modo analogo a come un lungo filo di lana è tenuto assieme dall’aggrovigliamento di fibre corte.
Gli alti pesi molecolari stimati mediante le proprietà colligative (abbassamento crioscopico, innalzamento ebulloscopico e pressione osmotica) erano ritenuti una conseguenza di quest’aggregazione.
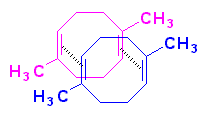
Anche sulla struttura della gomma naturale il dibattito era molto intenso, veniva stimato un peso molecolare M>100 000 uma (oggi sappiamo che il peso molecolare medio della gomma naturale è di circa 5·105). Nel 1905 il chimico tedesco Harries, elaborò una teoria secondo cui la gomma consisteva di molecole ad anello di 8 termini risultanti dalla combinazione di due molecole di isoprene; queste avrebbero formato grandi aggregati colloidali mediante deboli interazioni intermolecolari tra i doppi legami.
Il chimico inglese Pickles criticò l’ipotesi di Harries e propose, un modello ad anelli interconnessi costituiti da almeno 8 unità isopreniche ciascuno (analoghi ai catenani…).
Al contrario, Carothers era convinto della teoria delle ‘molecole giganti’ di Staudinger, ne intuì i grandi risvolti applicativi, e si impegnò nella loro sintesi.
Il grande chimico tedesco Emil Fischer, dopo aver scoperto il legame peptidico nelle proteine, nel 1907 aveva preparato mediante una complessa sintesi multi-step, un polipeptide di 18 residui con M= 4100, questo rappresentò a lungo il record di molecola di sintesi più ‘pesante’!
L’idea di Carothers (che lavorava alla DuPont) fu quella di sintetizzare una macromolecola con un peso molecolare superiore a quello ottenuto da Fischer. Da chimico organico conosceva la facilità con cui un acido carbossilico reagisce con un alcol, quindi per ottenere un poliestere progettò di far reagire un acido di-carbossilico con un glicole, secondo lo schema:
nHO-CO-(CH2)n1-CO-OH + n HO-(CH2)n2-OH → -(-CO-(CH2)n1-CO-O-(CH2)n2-O-)n– + 2n H2O
Per fare in modo che la sintesi fosse di valore applicativo era necessario partire da reagenti facilmente disponibili; la scelta cadde sull’acido adipico e sul glicole etilenico
nHO-CO-(CH2)4-CO-OH + nHO-(CH2)2-OH → -(-CO-(CH2)4-CO-O-(CH2)2-O-)n– + 2n H2O
Il problema non era quello di formare legami esterei, ma di ottenere alti pesi molecolari, con n sufficientemente alto. Tuttavia, non si riuscì ad andare oltre una poltiglia appiccicosa di oligomeri senza valore applicativo con M=3200.
La formazione di polimero ad alto peso molecolare è un processo entropicamente sfavorito; per raggiungere lo scopo sono necessarie condizioni sperimentali drastiche in cui ΔG<0. Apparve chiaro che era necessario rimuovere il glicole in eccesso e l’acqua di condensazione. Un’opportuna apparecchiatura fu realizzata e fu condotto un riscaldamento prolungato sotto alto vuoto. Finalmente, nel 1930 un polimero solido che dava fibre con M=12000 fu ottenuto. Era il primo polimero termoplastico di sintesi ad alto peso molecolare in cui le catene hanno una struttura lineare. Fu possibile ridurlo in fibre ma, ahimè, non era sufficientemente resistente alla temperatura (Tm<100 °C) ed ai solventi. Tuttavia, la strada era stata aperta! Molti di-acidi e glicoli furono passati in rassegna, fu considerata anche la reazione tra acido iso-ftalico e glicole etilenico.
Purtroppo venne saltata o non diede risultati preliminari incoraggianti quella tra acido tereftalico e glicole etilenico che sarebbe risultata la coppia vincente (Whinfield e Dickson, 1940) alla base dell’onnipresente PET
Carothers, scoraggiato dai poliesteri, dopo aver in volata preparato la prima gomma di sintesi (il policloroprene o neoprene nel 1930), volse la sua attenzione alle poliammidi: era ben noto che le ammidi sono resistenti alla temperatura e ai solventi meglio degli esteri in virtù dei legami idrogeno più forti nelle ammidi (resi possibili dall’unità peptidica planare), quindi si poteva prevedere che anche le poliammidi sarebbero risultate più resistenti dei poliesteri.
Furono considerati gli amminoesteri, in questo caso il composto eliminato per condensazione è un alcol più volatile dell’acqua e i gruppi reattivi sono perfettamente equimolari. Inoltre, per innalzare il punto di fusione considerò composti a catena alifatica lunga. Nel 1934 fu ottenuto il Nylon 9 ad alto peso molecolare, facile da estrudere e filare, resistente ai solventi ed al calore (Tm= 200 °C). Tuttavia, si trattava di un polimero troppo costoso.
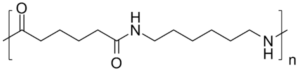
Si ripiegò sulla polimerizzazione di un di-estere ed una di-ammina ottenendo il Nylon 5,10 (5 indica il numero di atomi di carbonio dell’ammina e 10 quelli dell’estere). Tuttavia, era un polimero ancora troppo costoso.
La DuPont individuò nell’acido adipico e nell’esametilendiammina i reagenti più convenienti: si tratta di monomeri a 6 atomi di carbonio ottenuti a partire dal benzene e quindi dal petrolio. Finalmente, nel 1935 si ottenne il Nylon 6,6 che rappresentò una vera rivoluzione: materiale strategico durante la Seconda Guerra Mondiale (paracaduti, tessuti impermeabili, corde, fibre per pneumatici, parti meccaniche…), nel dopoguerra si diffuse per gli usi civili più vari, primo fra tutti le calze da donna.
Si legge che l’America vinse la WW II per i motivi più curiosi, uno di questi sarebbe stato il Nylon. Questa interpretazione è sicuramente falsa, perché il Nylon ce l’avevano pure i tedeschi! Infatti, avevano sviluppato il Nylon 6 (Schlack, 1938) per polimerizzazione dell’ε-caprolattame (un ammide ciclica a 7 atomi, 6 di carbonio).
Il Nylon è stata detta ‘seta artificiale’. Infatti, anche la seta, che è a base di fibroina, è una poliammide, con l’unità peptidica –NH-CO- planare e forti legami idrogeno. Tuttavia, vi sono almeno due grosse differenze. In una proteina i gruppi –NH- e –CO- si alternano secondo lo schema ABAB. Lo stesso accade nel Nylon 6; invece, nei Nylon m,n abbiamo uno schema AABB. Inoltre, in tutti i casi, nel Nylon abbiamo catene piuttosto lunghe tra A e B; al contrario, nelle proteine è presente l’unico atomo di carbonio Cα che reca il gruppo sostituente caratteristico. Infine, una proteina ha una struttura primaria (sequenza degli amminoacidi) altamente elaborata e specifica basata sui 20 amminoacidi naturali.
In tempi recenti le poliammidi hanno avuto uno sviluppo inatteso. Nel 1967 ancora alla DuPont fu inventata una poliammide aromatica dalla catena piatta e rigida con peso molecolare particolarmente alto. Furono trovate le condizioni per polimerizzare un cloruro aromatico acilico ed amminico (o un di-cloruro e una di-ammina aromatica), ottenendo le aramidi (poliammidiaromatiche).
Si tratta di polimeri altofondenti (Tm>500 °C) che vengono filati da soluzione. La prima aramide fu il Nomex costituita da anelli aromatici sostituiti in meta (meta-aramide):
Il Nomex non presenta elevata resistenza meccanica (le catene a causa dell’ingombro laterale non possono cristallizzare in modo ottimale), tuttavia può essere filato e si ottiene un tessuto resistente al calore, ideale per i vigili del fuoco, operai industriali e simili.
Inoltre, nel 1973 la DuPont brevettò il Kevlar, una fibra para-aramidica più resistente dell’acciaio, per modulo elastico e sforzo a rottura.
Stephanie Louise Kwolek riuscì a polimerizzare la para-fenilendiammina con il cloruro acilico dell’acido tereftalico.
Ottenne una soluzione lattiginosa particolarmente fluida che sembrava poco adatta ad essere filata: in genere, le soluzioni adatte alla filatura sono molto viscose. Tuttavia, si ottenne un filo dorato particolarmente resistente che non era possibile spezzare tirandolo con le mani! Il Kevlar è stato il primo polimero liquido cristallino liotropico: in soluzione si organizza in uno stato di ordine parziale con le lunghe e rigide catene orientate preferenzialmente nella stessa direzione. E’ questa la causa dell’opalescenza della soluzione e della ridotta viscosità. Inoltre il Kevlar, a differenza del Nomex, cristallizza in modo compatto formando una rete ordinata di forti legami idrogeno.
La fibra ottenuta dopo un accurato trattamento termo-meccanico, sviluppa una resistenza eccezionale, tanto da poter essere tessuta ed usata nei giubbotti antiproiettile.