Credo che molti di noi rimarrebbero delusi se scoprissero che i preziosi calici in cristallo di Boemia che tengono gelosamente custoditi nella cristalliera in salotto non sono in realtà cristalli ma vetri, e lo stesso dicasi per i cultori dell’automobile, che parlano ormai comunemente di “cristalli” per alludere al parabrezza del proprio mezzo.
Per trovare dei veri cristalli in casa nostra dovremo forse cercare nella dispensa, nei barattoli di zucchero e di sale, dopo di che avremmo tutto il diritto di fermarci per domandarci una buona volta: che cosa intendono i chimici (o meglio, gli scienziati in generale) con la parola cristalli?
In effetti le parole vetro e cristallo, spesso confuse fra loro nel linguaggio quotidiano, si riferiscono non soltanto a realtà fisiche, diciamo ad “oggetti”, in qualche modo diverse fra loro, ma a situazioni praticamente antitetiche con le quali si può presentare la materia allo stato solido: per fare una metafora, sarebbe quasi come confondere il bianco con il nero o il dritto con il rovescio!
ALL’INIZIO ERANO ENTRAMBE UN LIQUIDO
Per comprendere meglio la differenza fra un vetro ed un cristallo dobbiamo fare un passo indietro nella storia della nostra sostanza. Un passo che può risalire ad un’ora come a molti milioni di anni prima. Dobbiamo tornare alla nostra sostanza quando si trovava in forma fusa, ovvero allo stato liquido.
A temperature sufficientemente elevate, qualsiasi specie chimica che non sia andata prima incontro ad un’eventuale decomposizione (con formazione di specie chimiche diverse), raggiunge lo stato liquido attraverso una transizione di stato detta fusione. Questo stato può essere mantenuto fintanto che la sua temperatura resta nel range compreso fra il punto di fusione e quello di ebollizione di quella sostanza. Anche sostanze insospettabili come i sali inorganici, quindi di natura ionica, possono essere fuse, seppur a temperature molto alte: il cloruro di sodio infatti fonde ad 804°C, il biossido di silicio (la silice, che costituisce il principale componente della comune sabbia) addirittura 1723°C.
All’interno di un liquido le molecole risultano attratte l’una dall’altra e quindi non si separano liberamente sfuggendo in tutte le direzione come invece capita nello stato aeriforme, ma al contrario formano nel loro insieme un “corpo” più pesante dell’aria, dotato di un volume definito (ad una data temperatura) per quanto di forma varabile in funzione del contenitore dove esso viene posto. Ma la cosa più importante ai nostri fini è che le molecole di una sostanza allo stato liquido, quindi anche le sostanze fuse, grazie alla limitata forza di coesione fra le molecole che li compongono, presentano un grado di fluidità tendenzialmente elevato (i liquidi meno fluidi sono detti viscosi). Quando gli “attriti” fra le diverse molecole sono ridotti, ovvero quando è limitata la tendenza a formare legami intermolecolari, il liquido risulta particolarmente fluido ed in esso le molecole sono in grado di muoversi con un buon grado di libertà l’una rispetto all’altra, in pratica di “scivolare” una sull’altra come le molecole di acqua.
I CRISTALLI
Quando una sostanza allo stato liquido viene gradualmente raffreddata, le molecole tendono ad organizzarsi nello spazio disponibile in modo decisamente più strutturato, andando a sistemarsi una rispetto all’altra in punti e con orientamenti reciproci definiti in modo tale da ridurre il più possibile quella che potrebbe essere in un certo senso definita (i chimico-fisici più rigorosi mi perdonino!) come l’energia associata alla conformazione del sistema.
Numerosi sono i fattori che entrano in gioco nel determinare l’energia associabile ad un sistema di particelle uguali fra loro, come quello rappresentato da una sostanza fusa che inizia a solidificare per raffreddamento ed il maggior peso di uno o dell’altro dipende in larga misura del tipo di sostanza con la quale abbiamo a che fare, ovvero dalla sua struttura molecolare. Genericamente si può dire che le molecole si orientano una rispetto all’altra in un modo regolare, secondo uno schema per così dire modulare di costruzione del corpo solido, minimizzando gli spazi vuoti e massimizzando la compattezza dell’assemblaggio molecolare, certamente, ma subendo anche la fortissima influenza delle interazioni fra le singole parti delle molecole. Nella maggior parte delle molecole è infatti possibile riscontrare fenomeni di polarità (concettualmente non molto dissimili da quelli delle calamite) che derivano da una maggiore densità di elettroni su una o alcune parti della molecola rispetto che su altre, fenomeno questo dovuto a sua volta a particolari atomi o gruppi di atomi presenti nella molecola. Durante la solidificazione un importante criterio di minimizzazione energetica sarà quello di pervenire ad un orientamento reciproco fra le molecole tale per cui la massima parte di cariche parziali positive di una molecola sia orientata ed in prossimità della massima parte delle cariche negative di un’altra, e viceversa, evitando pertanto porzioni positive di molecole diverse arrivino troppo in prossimità l’una dell’altra, e lo stesso per le porzioni negative delle stesse molecole. L’orientamento dipolo-dipolo (in questo caso fra gli atomi di ossigeno e di idrogeno di molecole diverse) risulta tutt’altro che casuale già nell’acqua liquida, fissandosi definitivamente nel congelamento nella posizione di massimo accoppiamento reciproco.
Anche i legami doppi e tripli, ed in particolare la presenza di anelli aromatici come quello del benzene sono in grado di influenzare l’orientamento reciproco delle molecole quando la loro libertà di movimento si riduce gradualmente con il diminuire della temperatura: in particolare gli anelli benzenici, che possiamo facilmente immaginare come degli esagoni appiattiti su un piano bidimensionale, tendono ad avvicinare fra loro le loro facce piane, sotto l’effetto di un’interazione fra le loro rispettive nuvole elettroniche detta “interazione pi-greco pi-greco”. Per molecole piuttosto grandi, costituite magari da una catena di atomi, anche la forma che la singola molecola assume durante la solidificazione può costituire un fattore importante nel determinare il contenuto energetico del solido prodotto. Allo stato liquido molte di queste molecole di muovono snodandosi, distendendosi e ripiegandosi con grande libertà, tenendo ad assumere un po’ tutte le forme che l’organizzazione dei loro atomi legati consente loro: ci saranno certo delle “conformazioni” favorite che se dovessimo riprendere con una fotografia istantanea l’insieme di tutte le molecole vedremmo essere più ricorrenti, ma questo non impedisce che la stessa molecola continui a flettersi, distendersi, appallottolarsi e dispiegarsi come una ginnasta di aerobica. Proprio come una sportiva quando le viene viene detto “ok, riposo!” tende ad assumere una posizione quieta, tranquilla e senza tensioni inutili muscolari, allo stesso modo le stesse molecole quando devono organizzarsi nella solidificazione tendono ad assumere la forma, in linguaggio chimico “la conformazione” alla quale corrisponde in minimo energetico. Anche questa forma è influenzata da fattori di polarità, ma questa volta interni alla stessa molecola, di interazioni attrattive fra alcune parti della molecola (ad es. dalle sue eventuali catene di atomi di carbonio, che tendono in molti casi ad avvicinarsi disponendosi in modo parallelo), come anche dal fattore di ingombro dovuto a determinate parti “voluminose” della molecola (i cosiddetti “ingombri sterici”).
Sono quindi numerosi i fattori che entrano in gioco quando una sostanza allo stato liquido viene raffreddata gradualmente fino al punto di solidificazione: tutti questi fattori, portano comunque le molecole ad organizzarsi reciprocamente nello spazio tridimensionale in un modo preciso, modulare e riproducibile, caratteristico di quel tipo di sostanza.
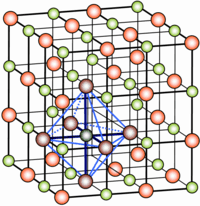
Una sostanza che solidifica secondo questi criteri si dice che “cristallizza”, ed il prodotto solido che risulta dal processo di cristallizzazione sono per l’appunto cristalli. Secondo la sua definizione, che siamo ora in grado di comprendere meglio, “un cristallo è un oggetto solido costituito da atomi, molecole o ioni (in pratica da qualsiasi specie chimica) aventi una disposizione geometricamente regolare, che si ripete indefinitamente nelle tre dimensioni, detta reticolo cristallino”.
La stessa cristallografia viene definita come la scienza sperimentale che si occupa di determinare la disposizione degli atomi nei solidi.
Non ci si sorprenda del termine “reticolo cristallino” appena introdotto nella definizione di cristallo: esso è semplicemente un modo di descrivere la disposizione geometrica tridimensionale dei punti occupati dagli atomi. Voglio tentare una metafora. Avete presente quelle pavimentazioni elaborate, comuni in molte antiche chiese o edifici nobiliari, dove mattonelle di forma e con motivi diversi sono incastrate fra loro per creare un motivo complesso che però si riproduce modularmente sull’intera superficie della sala? Se facciamo attenzione riusciamo a vedere che il motivo risulta descritto da un numero limitato di mattonelle fra loro confinanti, ipotizzo da nove mattonelle di forma e motivo diverso che messe insieme descrivono un grande fiore. Se le singole mattonelle rappresentano gli atomi e l’intero pavimento rappresenta il cristallo, queste nove mattonelle fra loro confinanti rappresentano la cosiddetta “cella cristallina”. Nel caso dei cristalli le celle cristalline sono tridimensionali. Si tratta di un gruppo di punti (occupati da atomi) che può essere preso a campione per descrivere l’organizzazione geometrica di tutto il cristallo. Il reticolo cristallino è invece l’insieme di “tutti” i punti occupati da atomi all’interno di un cristallo, quindi un insieme di atomi posti in posizioni regolari che si estende regolarmente all’infinito… almeno finchè si estende il cristallo.
La strutturazione di un solido sotto forma cristallina è favorita come crescita di uno o più cristalli già formati piuttosto che nella formazione di cristalli ex-novo a partire da un liquido che ne è ancora del tutto privo: eventuali cristallini già preformati presenti nel liquido (talvolta anche banali ed ubiquitarie impurezze insolubili, costituite anche da sostanze differenti) possono costituire una valida guida organizzativa per la solidificazione strutturata di nuova sostanza in forma cristallina, che in questo caso contribuirà alla crescita in dimensioni e peso dei cristalli già esistenti.
Abbiamo visto come la formazione di cristalli costituisca la modalità di solidificazione per certi versi più naturale a partire da un prodotto fuso. In realtà la cristallizzazione di una sostanza può avvenire anche a partire da una sua soluzione.
Nel caso di una soluzione ogni singola molecola di sostanza disciolta (soluto) risulta circondata da molecole di solvente e non manifesta pertanto la tendenza a coedere con altre molecole dello stesso tipo per formare aggregati più grandi. Siamo solitamente abituati a pensare alle soluzioni per antonomasia come quelle di un solido in un solvente liquido, ma in realtà possono esistere, ed anzi sono assai più comuni di quanto si pensi, soluzioni di una qualsiasi fase in qualsiasi altra, ad esempio di un gas in un liquido, di un liquido in un solido, di un solido in un gas, ecc.
La solubilità massima consentita di un dato soluto in un determinato solvente (in grammi di soluto per grammo di soluzione, oppure in moli/litro o in qualsiasi altra unità di misura la si voglia esprimere) è un valore che dipende da vari fattori fra i quali la temperatura e la pressione. Tenendo costante la pressione (ad esempio lavorando in contenitori aperti, alla pressione ambientale) possiamo far superare questo limite di solubilità o riducendo la temperatura (in quanto per la maggior parte delle sostanze la solubilità è direttamente proporzionale alla temperatura) oppure facendo evaporare gradualmente il solvente a temperatura costante, con il risultato che il rapporto fra peso di soluto e peso di solvente crescerà gradualmente. In entrambe i casi, la quota di soluto che avrà superato il limite di solubilità per quelle date condizioni inizierà a separarsi in forma cristallina, generando ex-novo piccoli cristalli o, ancora più facilmente, determinando la crescita in peso e dimensioni di cristalli della stessa sostanza già presenti nella soluzione.
Nella maggioranza dei casi i solidi con i quali abbiamo a che fare quotidianamente sono di tipo “policristallino”, ovvero sono costituiti da una moltitudine di cristalli minuscoli (detti cristalliti), talvolta così piccoli ed appressati saldamente l’un l’altro che possono facilmente sfuggire ad un’osservazione superficiale, facendoci percepire l’oggetto come costituito da un materiale uniforme e continuo. Tanto gli oggetti metallici quanto quelli di pietra, il cemento, diversi tipi di materiali plastici e le ceramiche sono esempi di materiali policristallini di uso comune. La ragione per la quale essi sono costituiti da una moltitudine di cristalli in alternativa ad un solo cristallo enorme dipende dal fatto che nel liquido di partenza (sostanza unica fusa oppure soluzione di più specie chimiche) il processo di formazione del cristallo è partito contemporaneamente o quasi in punti diversi del volume disponibile. Superata una fase iniziale di formazione dei primi nuclei cristallini (nucleazione) tendenzialmente non si formeranno cristalli nuovi ma quelli già formati continueranno a crescere, costituendo una sorta di guida organizzativa per la deposizione su di essi di nuovo materiale solido cristallino.
I cristalliti possono presentarsi all’interno dello stesso materiale policristallino in una molteplicità di dimensioni ed orientazioni spaziali diverse: le interfacce fra un cristalline e l’altro, dette “bordi di grano” possono così essere orientate secondo un po’ tutte le direzioni, rifrangendo di conseguenza la luce incidente in altrettante direzioni diverse con l’esito di caratterizzare il materiale il questione risulterà diafano nei confronti della luce incidente, fino alla caratteristica di completa opacità. Attraverso particolari tecnologie di preparazione è invece possibile far sì che tutti i cristalliti di un solido policristallino risultino orientati nello stesso modo, con bordi di grano fra loro paralleli: è il caso della strutture policristallina di tipo fibroso tipica di molti materiali plastici trasparenti come il plexiglass, il policarbonato, il polistirene (non espanso).
Esistono ovviamente anche solidi mono-cristallini, ovvero costituiti da un solo grande cristallo, cresciuto solitamente a partire da una fase liquida di elevata limpidezza, in condizioni di sovrassaturazione lievissima ed in tempi davvero molto lunghi… diciamo “geologici”.
E’ il caso delle moltissime gemme, pietre dure di tipo prezioso o semi-prezioso come lo smeraldo, il rubino, lo zaffiro e l’ametista, ma entro una certa misura anche di alcuni prodotti granulari o meglio “micro-cristallini” come il comune sale ed il comune zucchero usati in cucina: in questi casi ogni granello è costituito da un cristallo differente, anche se potrebbero essere tutt’altro che rari i casi in cui due o più cristalli risultino attaccati insieme, tanto più se si considera che si tratta di materiali igroscopici, che tendono a compattarsi con l’umidità (formazione di legami idrogeno fra molecole di acqua, che fungono da ponte, e due cristalli vicini).
Con una buona lente d’ingrandimento o un microscopio chiunque può passare in rassegna cristallo per cristallo il cloruro di sodio del barattolo in cucina per determinare quanti monocristalli siano in esso presenti, tenendo conto comunque che questa caratteristica non influenza in nessun modo le caratteristiche di questo prodotto una volta che esso viene sciolto in acqua.
Una delle caratteristiche fondamentali che differenzia i materiali cristallini (soprattutto i monocristalli) dai materiali amorfi come i vetri è l’elevato grado di anisotropia tipico dei cristalli. Numerose proprietà fisiche ed alcune proprietà chimiche dei cristalli dipendenti da una qualche sollecitazione esterna, possono variare anche in modo radicale a seconda della direzione rispetto al singolo cristallo dalla quale proviene la sollecitazione. Un esempio è il comportamento nei confronti della luce, che può essere riflessa o rifratta in modo diverso a seconda della faccia sulla quale agisce il raggio, la trasmissione di calore e di elettricità, ed infine anche la risposta ad una sollecitazione meccanica forte come ad esempio un urto. E’ noto infatti che i cristalli non possono essere liberamente spezzati nella direzione voluta per cosi dire “a colpi di scalpello”, ma ogni azione meccanica forte avrà successo soprattutto se sarà esercitata nella direzione di determinati piani di taglio, la cui direzione dipende indirettamente dalla forma del reticolo e quindi della cella cristallina. Il risultato di questo è che minuscoli o molto grandi che siano, i cristalli della stessa sostanza tenderanno ad assumere sempre la stessa forma, il loro cosiddetto “abito cristallino” tipico.
Avremo modo di approfondire meglio l’affascinante fenomeno della cristallizzazione e le sue strategie di conduzione in un prossimo intervento specificamente dedicato all’argomento.
I VETRI
E’ possibile che vi sia sfuggito, sembrava una parolina messa lì giusto per caso, ma quando ho descritto proprio nella prima riga le condizioni che portano alla cristallizzazione di un liquido, ho detto “Quando una sostanza allo stato liquido viene gradualmente raffreddata”… E’ su questo “gradualmente” che si gioca tutta la differenza fra un vetro ed un cristallo.
Il processo di riordino delle molecole, la modifica della loro conformazione spaziale indirizzata al raggiungimento di quella ottimale a minore energia, l’orientamento reciproco di queste molecole, la loro migrazione destinata a coprire i punti che definiscono il reticolo ideale per la cristallizzazione di quella determinata sostanza, sono tutti fenomeni che comportano in un modo o nell’altro il movimento su scala microscopica di molecole o di parte di esse, secondo moti traslazionali e rotazionali. Come per gli oggetti macroscopici, anche nell’ambito non propriamente quantistico rappresentato dalle molecole e degli ioni, questi movimenti non posso sicuramente essere immaginati come istantanei ed anzi, in taluni casi richiedono un certo tempo per realizzarsi.
In un liquido molto viscoso, come sono in effetti tantissimi quando la temperatura si abbassa fino in prossimità del punto di salificazione o congelamento, la viscosità cresce in modo molto accentuato, tale da rallentare anche in modo significativo i movimenti di molecole e ioni. Ho navigato per più di un ora in internet su youtube e vi assicuro che non ho reperito (ne ricordo di aver mai visto finora) un video dove il vetro fuso apparisse più fluido, ovvero meno viscoso, di quella sorta di pasta giallo-arancio arroventata e luminescente che siamo solite vedere lavorare da sapienti artigiani presso i loro laboratori. Di fatto, a quanto mi è dato apprendere, non vi sarebbe una forte motivazione tecnologica (se non per applicazioni davvero speciali in campo tecnologico) nello spingersi a temperature maggiori, difficili e costose da ottenere e da mantenere nel tempo, essendo la pasta di vetro ottimamente lavorabile anche e soprattutto nelle condizioni di liquido viscoso.
Quando il raffreddamento del liquido avviene troppo rapidamente, accade semplicemente che la viscosità divenuta davvero molto elevata impedisce al sistema di raggiungere il suo equilibrio geometrico e quindi il suo minimo energetico. Se conformazione molecolare ed orientamento reciproco tutto sommato richiedono piccoli movimenti, soprattutto rotazionali ed “in loco”, la disposizione delle molecole, o degli atomi, o degli ioni nei nodi del reticolo cristallino ideale per quella sostanza richiedono spesso movimenti molecolari anche di tipo traslazionale, anche di più ampia portata. Le molecole restano quindi lì dove sono, anche se la situazione è ben lungi dall’equilibrio, e più passa il tempo e più il sistema si raffredda meno esse sono in grado di muoversi. Finchè la viscosità cresce a tal punto da rendere compatto e solido il materiale in questione: abbiamo creato un vetro.
E’ come se nel noto gioco della sedia la temperatura nella sala scendesse improvvisamente ad una valore tale che tutti dovessero rimanere congelati lì dove sono: con i posti solo in parte occupati e tanta gente in piedi nelle posizioni più improbabili. Guardando un’istantanea di questa scena si crederebbe che la gente stia ancora ballando. Ed allo stesso modo, la disposizione delle molecole o degli atomi in un vetro ricorda molto da vicino quella che si sarebbe potuta osservare nel liquido di partenza, semplicemente ora le molecole non si muovono più liberamente l’una rispetto all’altra ma risultano di fatto “congelate” nelle posizioni più diverse: considerando la massa del prodotto, ovvero un grandissimo numero di molecole, potremmo praticamente dire che vi sono molecole orientate e direzionate secondo tutte le direzioni possibili.
Da questo deriva il fatto che, salvo possibili lievi fluttuazioni di densità, impurezze ed inclusioni disperse, un vetro è un materiale isotropo: a differenza di un cristallo le sue caratteristiche fisiche non variano in relazione alla direzione di osservazione o di prova. Presenterà grosso modo la stessa trasparenza nei confronti della luce, la stessa conduttività termica, la stessa durezza e, diciamo così, la stessa propensione a rompersi indipendentemente dalla direzione dalla quale proverrà la sollecitazione.
In linea teorica tutte le sostanze potrebbero solidificare come vetro. Nella pratica, non sono molte quelle che sono suscettibili di questa modalità di solidificazione. Per poter vetrificare con un normale abbassamenti di temperatura, senza ricorrere ad abbattitori di calore in grado di far crollare la temperatura di un corpo in pochi istanti, fra le molecole di un liquido devono sussistere delle resistenze al libero scorrimento, dovute per lo più a forti interazioni attrattive fra le diverse molecole, o eventualmente a ragioni dette steriche, legate cioè all’ingombro spaziale delle molecole o di parti di esse. In entrambe i casi il liquido presenta ad una osservazione macroscopica una elevata viscosità, ed in ultima analisi una velocità di cristallizzazione spontanea particolarmente lenta.
Oltre al biossido di silicio (base fondamentale per la formulazione dei vetri così come li intendiamo nell’accezione comune), altri ossidi tendono a vetrificare con facilità: i’anidride borica, il diossido di germanio, l’anidride arsenico e l’anidride fosforica. L’ossidiana è un vetro di origine naturale, disponibile in vari colori ma nota soprattutto per il nero, che si forma nel momento in cui le lave vulcaniche ad altissima temperatura si raffreddano molto rapidamente per contatto con l’aria o meglio ancora con l’acqua: essa è usata per la realizzazione di gioielli e come materiale tecnologico per varie applicazioni.
L’opale poi è davvero un caso strano e degno di una descrizione più approfondita: esso è costituito da minuscole sferette di silice amorfa, ovvero da quella che potremo definire un vetro, ma esse sono a loro volta impaccate ed organizzate in modo regolare sui nodi di un reticolo cristallino proprio come se ciascuna sferetta di vetro fosse un atomo o una molecola singola. In aggiunta a questo, l’opale contiene fino ad un 20% di acqua legata chimicamente all’interno di essa: tutte condizioni queste indispensabili per la resa di quell’effetto di luce e di colori noto appunto come “opalescenza” che è dato dalla combinazione di effetti di interferenza e di diffrazione della luce.
Diventa comunque difficile per la maggior parte di noi pensare al “vetro” come ad un’idea generale, ad una forma di aggregazione della materia allo stato solido, senza far coincidere necessariamente questa immagine con quella del vetro comunemente detto, quello diciamo di uso quotidiano. Questo risulta costituito essenzialmente da biossido di silicio (silice), formalmente SiO2 ma che nel contesto specifico, grazie anche all’aggiunta di altri ingredienti quali sali di sodio, di calcio e di alluminio, forma un reticolo tridimensionale e complesso, dove lo scheletro principale è costituito da atomi di silicio che legano a loro volta in modo covalente quattro atomi di ossigeno, a loro volta legati ad altro silicio. L’alluminio può eventualmente sostituire in qualche punto in silicio, mentre un certo numero di atomi di ossigeno risultano ionizzati (conferendo alla sottostruttura la qualità di anione silicato) grazie anche alla presenza di cationi come il sodio o il calcio. Alcuni atomi di ossigeno, soprattutto quelli posti più sulla superficie sul materiale, possono legare direttamente un idrogenione, costituendo il gruppo Si-OH noto come silanolo.
Composizione, struttura e proprietà del vetro, proprio lui, quello “comune”, a base di biossido di silicio, costituiscono un insieme di conoscenze talmente complesso ed affascinante, anche in relazione alle implicazioni che ne derivano per la nostra vita domestica, che si renderà presto necessario editare un intervento specifico su questo argomento.
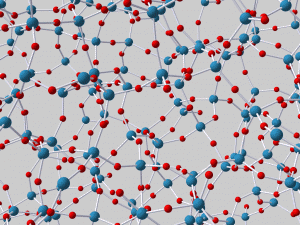
Per ora potrà essere sufficiente osservare l’esempio di struttura riportata a lato (che fra l’altro rappresenta un ipotetico vetro di silice pura, senza né sodio, né alluminio o altri coadiuvanti tecnologici aggiunti), per comprendere come un vetro sia basato su un reticolo veramente fitto di legami, tutti fra l’altro molto forti in quanto di natura prevalentemente covalente. Non stupisce quindi che la formazione incipiente di questi legami possa costituire un forte ostacolo nei confronti della fluidità del liquido rappresentato dal vetro fuso, rendendo la sua cristallizzazione veramente molto difficile ed orientando il processo di solidificazione nella direazione della formazione di una massa amorfa, il vetro appunto, estremamente simile nella disposizione dei suoi atomi e dei suoi legami al liquido dal quale si è formato.
Infatti, per quanto possa suonare incredibile, i vetri sono spesso descritti come: “liquidi sotto raffreddati ad elevatissima viscosità, i cui legami intramolecolari e gli attriti interni ne mantengono inalterata la forma per un tempo lunghissimo”.
Per lunghissimo tempo? Non per sempre?
Sì, in effetti almeno in linea teorica un vetro non è un materiale stabile, e non soltanto per la sua facilità a frantumarsi con gli urti. Un campione o un manufatto di vetro conservato per un tempo sufficientemente lungo tende comunque a trasformarsi cristallizzare. Per quanto tenacemente imbrigliati dai suddetti legami intermolecolari ed attriti, in condizioni anche di poco superiori al valore di temperatura corrispondente alo zero assoluto (come ad esempio alla nostra temperatura ambientale) atomi, ioni e molecole riescono ancora, seppur con estrema difficoltà, a compiere qualche movimento anche attraverso lo stato solido. Ed i movimenti saranno certamente in direzione di quegli agognati punti del reticolo cristallino ancora mai raggiunti, a cui corrisponde l’eden molecolare della minore energia interna del sistema.
Possiamo quindi consolarci di fronte al fatto che i nostri calici di Boemia non sono dei veri cristalli: lo diventeranno un giorno, forse fra migliaia di anni, ma è probabile che il loro aspetto cristallino possa poi deluderci.
Se proprio volevamo dei cristalli, forse era meglio investire il tempo per effettuare una solidificazione più lenta.