Quello di solvente, per un chimico, non è un modo per identificare una sostanza e neppure un loro gruppo. In modo più sottile direi che non è neppure un modo per identificare sostanze accomunate da una determinata proprietà – quella di solubilizzarne altre – dal momento che questa proprietà potrebbe essere virtualmente espressa, nelle idonee condizioni, un po’ da tutte le sostanze conosciute.
Quello di solvente è piuttosto quello di identificare il ruolo che una sostanza esprime rispetto ad altre nell’ambito di un determinato contesto, nel caso specifico di un miscuglio omogeneo.
Un solvente è per tanto la sostanza chimica che, nell’ambito di un miscuglio di più specie chimiche che sia omogeneo su scala molecolare (detto anche soluzione), è presente in quantità maggioritaria, tale per cui le sue molecole circondino integralmente quelle delle altre sostanze presenti (che in questo contesto assumono il ruolo di soluti), riducendone sia le interazioni reciproche che quelle con forze esterne (ad esempio quella di gravità). Non è di certo la definizione più rigorosa che possa essere data di questi termini ma credo renda molto bene l’idea.Per fare una metafora nell’ambito dei rapporti sociali tra persone è un po’ come parlare di “capo”. Nessuno di noi è intrinsecamente capo: non lo è su base genetica né lo si potrebbe identificare come tale se lo si estrapola dal suo contesto sociale, ad esempio lavorativo o di gruppo. Un capo esprime la sua attitudine (nello specifico quella della leadership) in riferimento ad uno specifico gruppo di persone e relativamente ad un ambito specifico (es. quello lavorativo, organizzativo, sociale, ecc): un capo senza altre persone sulle quali esercitare la propria leadership ed al di fuori di ogni ambito non è un capo, è semplicemente un individuo come gli altri. E’ inoltre possibile che la stessa persona sia capo di altre in un determinato ambito (es. sul lavoro) mentre non lo sia in altri (es. in una squadra sportiva) dove il soggetto che assume il ruolo di capo è un’altra.
L’omogeneità nel caso della soluzione va ricercata sicuramente a livello microscopico, addirittura a livello molecolare dal momento che a differenza di una semplice dispersione in una soluzione ciascuna molecola – o ciascun ione nel caso di sostanze elettricamente cariche – risulta isolato dagli altri e completamente circondato da molecole del solvente, ovvero da esse “solvatato”. Se le particelle fossero anche soltanto di un paio di ordini di grandezza più voluminose, ad esempio comprese tra 1 e 1000 nanometri, non si dovrebbe per la precisione parlare di soluzione ma di dispersione colloidale, e questi ultimi miscugli godono in effetti di caratteristiche non poco dissimili da quelle delle soluzioni vere e proprie.
In una situazione, dove ogni particella “conta per sé”, non c’è da stupirsi se ciascuna di essa non “affondi”, sedimentandosi sotto l’effetto della forza di gravità: essendo quella di gravità appunto una “forza” essa risulta proporzionale alla massa del corpo stesso, che nel caso di una singola molecola separata dalle altre conta pochissimo. Così poco da essere vinta dalla forze di dispersione, sempre presenti in un liquido e quindi anche nelle soluzioni, che fanno sì che le molecole si muovano ciascuna rispetto alle altre di un moto disordinato e casuale, di ampiezza sull’ordine dei micrometri, noti come moti browniani. Questi movimenti finiscono per coinvolgere anche le molecole del soluto, spesso non così enormemente più grandi di quelle del solvente o comunque ad esso ben legate tramite legami che, seppur non fortissimi e suscettibili di continua rottura e riformazione, sono comunque molteplici. La capacità di questi moti di mantenere in sospensione le particelle – diverse da quelle del solvente – presenti nel liquido, può estendersi in alcuni casi anche a molecoli in effetti non del tutto solvatate, come ad esempio i colloidi o particelle ancora più grandi come ad esempio corpuscoli di polvere: non a caso il fenomeno prende il nome dal botanico Roberto Brown che nel 1827 lo descrisse osservandolo in una sospensione acquosa di polline di piante.
SIGNIFICATI ED ETIMOLOGIA DI SOLUZIONE
Infine una nota linguistica. Anche nel linguaggio comune, la parola “soluzione” assume due principali significati distinti:
– Il fatto di risolvere, d’essere risolto, e il modo, il procedimento con cui si risolve, o più spesso il risultato che si ottiene e che risponde alla domanda iniziale.
– Lo sciogliere, lo sciogliersi, l’essere sciolto, di una sostanza, solida o liquida, in un’altra, generalmente liquida; specialmente nel linguaggio della fisica e della chimica.
Secondo il vocabolario Treccani, tuttavia, al primo posto in termini di significati è posta quest’ultima, con specifico riferimento alla chimica, ed anche l’etimologia del termine viene a supportarci in questo senso: soluzióne s. f. [dal lat. solutio -onis, der. di solvĕre «sciogliere», part. pass.solutus].
Personalmente, anche se non so quanto la cosa possa trovare riscontro etimologico, trovo che il ponte tra i due significati possa essere trovato tramite un terzo e magari anche da un quarto significato riportato dallo stesso Treccani:
– Interruzione, soprattutto nell’espressione s. di continuità, interruzione nella continuità spaziale o temporale.
– Nel diritto romano (lat. solutio), pagamento, liberazione da un’obbligazione, da un debito e sim. Il sign. rimane tuttora in espressioni del linguaggio comm. Quali pagare in una sola s., pagamento fatto o da farsi in un’unica s., in una sola volta, tutto insieme.
In questo, vi dicevo, vedo quella chimica come una interruzione, una “soluzione di continuità” dei legami che uniscono fra loro le molecole o gli ioni del solido iniziale – ammettendo ovviamente che sia solido – così come anche a livello macroscopico l’integrità della particella stessa introdotta nel solvente – immaginato liquido. Questo porta alla conseguenza di una “liberazione” delle particelle stesse della sostanza introdotta in soluzione. E così il cerchio etimologico si chiude.
LA SOLVATAZIONE DELLE MOLECOLE IN SOLUZIONE
Una questione chiave è relativa a “quanto” il solvente, per comportarsi come tale, possa o addirittura “debba” interagire con le molecole del soluto. Se da un lato una mancanza totale di interazione renderebbe nullo lo stesso potere solvatante – fino a portare il miscuglio in condizioni eterogenee – un’interazione particolarmente forte potrebbe portare alla formazione di addotti chimicamente ben definiti, caratterizzabili o addirittura isolabili: in quest’ultimo caso sarebbe forse più corretto parlare di specie chimica reagente piuttosto che solvente. Non dimentichiamoci mai che è pur sempre l’uomo ad “inventarsi” categorie, come quella di solvente e di reagente appunto, per cercare di mettere un po’ d’ordine nelle osservazioni che raccoglie e trovare per essere un minimo comun denominatore fra alcune di esse. Un solvente per poter essere tale, ovvero per poter solvatare molecole di una certa sostanza presente in miscela in quantità minoritaria deve espletare con esso una qualche forma di interazione. Si pensi per esempio ad una sostanza presente inizialmente allo stato solido, nella maggior parte dei casi cristallino: in un reticolo cristallino esistono delle forze di coesione che tengono unite le varie molecole e che devono essere vinte da qualcosa di ancora più vantaggioso dal punto di vista energetico. Non sarà probabilmente una spiegazione degna di un fisico termodinamico, ma si potrebbe dire in qualche modo che nel caso di una buona solvatazione con un solvente idoneo, l’energia di solvatazione riesce a vincere quella di cristallizzazione.
Le interazioni che si possono stabilire tra soluto e solvente, perchè quest’ultimo sia da ritenersi tale, devono essere relativamente deboli e comunque perfettamente reversibili, tali per cui in ogni momento risulti possibile senza grande sforzo tornare a separare il soluto dal solvente, ad esempio per evaporazione. Sono quindi importanti le forze di Van der Waals, presenti in tutti i materiali, ma anche le interazioni dipolo-dipolo (sia con dipoli permamenti che indotti) e nella solvatazione di sostanze ioniche come il sodio cloruro della figura qui sopra anche ione-dipolo, ed infine per le molecole polari e protiche i legami idrogeno.
L’entalpia (H) di idratazione è invece il concetto termodinamico che meglio viene in soccorso per spiegare la ragione per la quale la solvatazione, e a seguire la solubilizzazione nel solvente (qui quasi necessariamente acquoso) si verifichi per alcuni reticoli ionici e non per altri. Riprendendo l’accenno precedente, la differenza di energia tra quella necessaria per rilasciare uno ione dal suo reticolo cristallino e quella guadagnata in positivo quando questo ione di combina con una molecola del solvente è detta variazione di entalpia di soluzione. Già da come è disposta la differenza si comprende come un valore negativo di entalpia di soluzione corrisponde ad uno ione che è possibile sciogliere in quel dato solvente, mentre un valore positivo significherà una mancata possibilità di solvatazione.
In realtà un ulteriore vantaggio energetico che può promuovere la solubilizzazione deriva anche dall’aumento di entropia (S) del sistema a seguito del disfacimento di una struttura altamente organizzata e con pochissimi gradi di libertà, quale è il cristallo appunto, a favore di un sistema sicuramente a maggior entropia qual è quello in soluzione. Questo ulteriore contributo può far sì che una sostanza di dissolva anche nel caso in cui la sua semplice variazione di entalpia di soluzione risulti positiva.
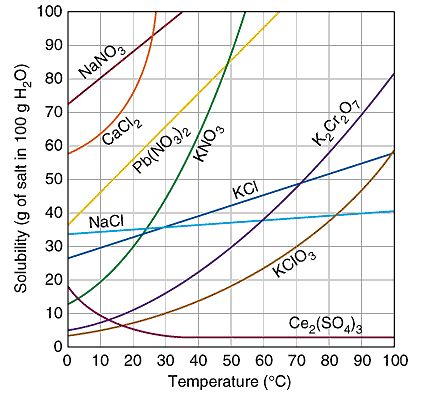
Questa è tra le ragioni per le quali si osserva spesso nella pratica come un riscaldamento favorisca nella maggior parte dei casi non soltanto una più veloce dissoluzione del solido introdotto (contributo alla cinetica del processo, al pari della raffinazione in piccolissime particelle dell’aspirante soluto) ma anche, in condizioni di equilibrio raggiunto, ad una maggiore quantità di soluto che può entrare in soluzione, ovvero ad una maggiore concentrazione raggiungibile dalla soluzione. Nel grafico qui a fianco sono sovrapposte le curve di solubilità in acqua in relazione alla temperatura alcuni sali inorganici: si noti per esempio come il sodio cloruro (NaCl), in azzurro, incrementi modestamente la sua solubilità anche in acqua all’ebollizione, mentre il potassio nitrato (KNO3), in verde, la incrementi con tale rapidità da poter creare acquose concentratissime con acqua a poco pià di 50°C. Un caso anomalo da questo diagramma sembrerebbe invece essere il cerio solfato – Ce2(SO4)3 – per il quale si assiste ad una diminuzione della solubilità in acqua al crescere della temperatura.