Indice
L’impiego del sale sparso sulle strade in inverno in qualità di antineve ed antighiaccio è una prassi consolidata ed efficace, dietro alla quale si celano però azioni specifiche fra loro diversificate, giustificate ciascuna da fenomeni fisici distinti, alcuni più semplici da descrivere, altri che richiederebbero una trattazione scientifica più rigorosa.
In particolare è possibile fare una distinzione fra due azioni ben distinte:
1) l’effetto anticongelante “preventivo” del sale;
2) l’azione di promozione dello scioglimento del ghiaccio già formato, o anche della neve (depositata o di successivo deposito) che in fondo non è altro che ghiaccio finemente cristallizzato.
Nella realtà concreta della gestione della sicurezza sulle strade, spesso distinguere fra le due azioni risulterebbe uno sterile esercizio formale, dal momento che spargendo il noto cloruro di sodio in cristalli grossolani, frammisto come solitamente accade di materiali inerti anch’essi grossolani quali sabbia e ghiaia, gli effetti sono entrambe assicurati.
Comprendere la differenza fra le due azioni risulta invece particolarmente importante per affrontare esigenze di ottimizzazione dell’efficacia ed eventualmente dell’economizzazione di questa pratica, individuando eventuali azioni di miglioramento e confrontando con visione critica l’approccio alla stessa problematica adottato in diversi Paesi del mondo e, nello stesso Paese, in situazioni diverse (es. aeroporti, autostrade, temperature moderatamente o estremamente basse, ecc).
L’azione di cui al punto 1), ovvero quella di prevenire il congelamento dell’acqua, già presente sul manto stradale o che potrebbe depositarsi sotto forma di pioggia o condensa, è probabilmente l’azione più immediatamente comprensibile ed intuitiva del sale antighiaccio.
Come noto a molti, in questo caso il sale agisce abbassando la temperatura di congelamento dell’acqua. L’umidità che bagna l’asfalto in questo modo anziché solidificare trasformandosi in ghiaccio si manterrà allo stato liquido anche diversi gradi al di sotto dello zero… a meno che la temperatura scenda al di sotto di una temperatura tale che neppure l’azione del sale sarà più efficace. Tuttavia qualsiasi sostanza solida solubile in acqua e sparsa sulle strade potrebbe poco o tanto esercitare un’azione di questo genere.
Il fatto che solitamente utilizziamo il cloruro di sodio, fra l’altro in una forma decisamente grezza, ovvero ricca di sabbia e di altre impurezze, ovviamente ben lontano dal grado alimentare di purezza, è dovuto in primo luogo al suo basso costo, in secondo luogo dalla sua non pericolosità, e in ultima analisi come vedremo al fatto che anche se non è in effetti la migliore in assoluto, le sue performance risultano collocarsi fra le migliori raggiungibili fra i prodotti chimici disponibili su larga scala.
L’abbassamento della temperatura di congelamento (meglio detta di solidificazione) di un liquido in un solido per aggiunta di una sostanza chimica sciolta all’interno del liquido prende il nome di abbassamento crioscopico. Crioscopia può essere tradotto volgarmente come “la visione del ghiaccio”. Essa appartiene alle cosiddette proprietà colligative delle soluzioni, insieme ad altre note proprietà quali l’innalzamento ebullioscopico e la pressione osmotica.
La peculiarità che contraddistingue tutte le proprietà colligative delle soluzioni è che esse non sono influenzate dalla tipologia di sostanza chimica, ovvero dalla specie chimica, che viene sciolta ma unicamente dalla sua concentrazione e dal tipo di liquido interessato, salvo restando ovviamente le stesse condizioni ambientali.
In formula di può riassumere il tutto scrivendo
![]()
ovvero
abbassamento del punto crioscopico = costante crioscopica x concentrazione molale del soluto
In pratica:
– l’abbassamento crioscopico è di quanti gradi si abbasserà il punto di congelamento del liquido (in questo caso acqua) rispetto agli 0°C; un abbassamento di 4 significherà che l’acqua in questione congelerà a -4°C;
– la costante crioscopica Kc è specifica del liquido, quindi se parliamo di congelamento dell’acqua rimane sempre la stessa, indipendentemente dal tipo di sale o di altra sostanza chimica che possiamo decidere di sciogliere in essa;
– la concentrazione detta “molale” (m) del soluto è proporzionale alla quantità di sale o di sostanza chimica solubile in generale, rispetto alla quantità di liquido presente.
Per chi fosse interessato ad approfondire le modalità di calcolo dell’abbassamento crioscopico, ad esempio per trovare quanto sale è necessario aggiungere ad una certa quantità di acqua per abbassarne di un determinato numero di gradi la temperatura di congelamento, ma non solo, ho preparato al fondo di questo intervento una sezione di approfondimento “stechiometrica dell’abbassamento crioscopico”.
Volendo prendere in esame le quantità richieste, a titolo di esempio, emerge che per abbassare a -5°C la temperatura di congelamento dell’acqua bisognerebbe sciogliere in essa 157 g di sodio cloruro. Una quantità che a prima vista potrebbe sembrare davvero un po’ eccessiva. D’altra parte si pensi che un litro di acqua, distribuito uniformemente su di una superficie piana sotto forma di uno strato dell’altezza di 1 millimetro, occupa esattamente un metro quadrato. Quindi una dose di 157 g di sodio cloruro per metro quadrato di strada.
Se si tiene conto che il sale per uso neve comunemente utilizzato non è sodio cloruro puro ma in esso è contenuta anche una grande quantità di altre impurezze inerti, ad iniziare dalla sabbia, da dose di questo sale per rispettare le risultanze dei calcoli stechiometrici dovrebbe essere ancora maggiore.
Nel caso dell’acqua marina ed oceanica, la cui salinità varia in relazione alle zone del pianeta, con una media globale del 3,5% di sali disciolti, il punto di congelamento (o di fusione) viene a localizzarsi intorno a -1,9°C. Quella che congela tuttavia non è “acqua salata”, nel senso che il ghiaccio che si forma anche a partire da acqua salina è comunque ghiaccio virtualmente puro, mentre i sali vengono esclusi dal reticolo cristallino e restando così in soluzione, ulteriormente concentrati, nella poca acqua che rimane ancora intorno al ghiaccio in formazione. E’ per questo che si dice che la salinità degli oceani tenderà a diminuire in relazione allo scioglimento dei ghiacci, e viceversa nelle glaciazioni essa è stata osservata più elevata.
Facendo i dovuti calcoli, emerge che vi è un limite di temperatura al di sotto del quale il sodio cloruro non potrebbe ridurre ulteriormente il punto di congelamento per abbassamento crioscopico: questo limite deriva dalla solubilità stessa del sodio cloruro in acqua, che non è infinita ma limitata a 36.0 g/100g di soluzione a 20°C, che si riduce di poco, a 35.7°C g/100g, agli 0°C ai quali si opera più realisticamente in occasione del suo impiego invernale.
Utilizzando le equazioni riportate in appendice, risulta che l’abbassamento crioscopico massimo, a fronte di questo limite di solubilità a 0°C è di 22,73°C (quindi una temperatura di congelamento della soluzione di sodio cloruro al limite di saturazione di -22,73°C).
Di fatto però il cloruro di sodio utilizzato in modalità preventiva, ovvero per prevenire il congelamento dell’acqua sul manto stradale tramite abbassamento crioscopico del punto di congelamento, non risulta essere particolarmente adatto per temperature che scendano al di sotto dei -7°C, anche perché le dosi da utilizzare in questo caso sarebbero veramente ingenti.
Oltre ai problemi di natura ambientale derivanti dal dilavamento del sale nei terreni agricoli e nel verde urbano, e a quelli legati all’azione lievemente corrosiva che le soluzioni saline concentrate come la salamoia possono esercitare su alcuni materiali, ad esempio quelli metallici, ci si può infatti trovare di fronte ad un problema fisico oggettivo: la solubilità del cloruro di sodio in acqua infatti non è infinita, tutt’altro. A temperatura ambiente
In questi casi possono essere utilizzati degli altri sali, in primo luogo il cloruro di calcio, che però ha lo svantaggio di costare almeno 5 volte il sodio cloruro, da solo o mescolato con il comune sale anti-ghiaccio. Uno dei principali vantaggi del calcio cloruro nella forma cristallina più comunemente utilizzata per le applicazioni antigelo è che esso si scioglie nell’acqua sviluppando un intenso calore, che si traduce inevitabilmente in un innalzamento della temperatura della soluzione salina che bagna il manto stradale, posticipando ulteriormente il suo congelamento. Oltre di ciò esso risulta oggettivamente più solubile in acqua del sodio cloruro: 74,5 g/100 g di soluzione a 20°C e 59,5 g/100 g a 0°C.
La lista delle sostanze chimiche solubili, non necessariamente sali, che possono essere utilizzate in queste applicazioni è potenzialmente lunghissima ed include, a titolo di esempio, oltre ai già considerati sodio cloruro e calcio cloruro:
potassio cloruro, magnesio cloruro, ammonio solfato, ammonio nitrato, fino ad arrivare a sali organici come il calcio e magnesio acetato ed il potassio acetato, e molecole organiche di tipo non salino come l’urea ed il glicole propilenico (queste ultime utilizzate di solito principalmente per le piste degli aeroporti).
L’utilizzo di prodotti anticongelanti da sciogliere in acqua, diversi dal tradizionale cloruro di sodio, può essere motivata da due distinte ragioni.
La prima ragione è legata alla compatibilità di queste sostanze con i materiali che devono venirne, e spesso rimanerne, a contatto anche in modo continuativo: è noto che in ambito industriale, nonché nei motori delle nostre automobili, l’antigelo introdotto in miscela nel sistema di raffreddamento ad acqua non è attualmente un sale, bensì molecole organiche altamente solubili, o meglio ancora esse stesse liquide, solubili in qualsiasi rapporto con l’acqua, non corrosive ed incapaci di formare le incrostazioni, anche nel caso peggiore della totale evaporazione dell’acqua, alle quali si potrebbe andare incontro con l’impiego non soltanto del cloruro di sodio ma di quasi tutti i prodotti di natura solida, specie se di natura inorganica. Anche nel caso dello spargimento su strade o piste di decollo ed atterraggio degli aeroporti, il problema delle incrostazioni può essere significativo, non tanto per quanto riguarda il manto stradale, quanto gli ugelli stessi dell’erogatore che avrebbe la funzione di spargere sulla superficie il prodotto liquido finemente suddiviso.
La seconda ragione dell’utilizzo di questi prodotti più “esotici” risiede in quella “m” riportata nella formuletta per il calcolo dell’abbassamento crioscopico. Quella “m” abbiamo detto che indica in qualche modo la concentrazione del soluto, ma non si tratta di una concentrazione percentuale o in grammi per litro come siamo abituati ad immaginare, bensì di una concentrazione definita “molale”.
La concentrazione molale è il numero di moli che è sciolto per ogni chilogrammo di solvente.
Ed una mole a sua volta equivale al peso in grammi del prodotto, diviso per il suo peso molecolare (o meglio: il peso formula, trattandosi spesso di un sale): quello che si ottiene tavola periodica degli elementi alla mano, sommando il peso atomico di tutti gli atomi che entrano a far parte della formula della molecola o del sale, moltiplicati per il loro coefficiente stechiometrico, ovvero per il numero che compare in pedice a destra di ogni simbolo atomico.
Per il cloruro di sodio, come del resto per quasi tutti i sali, entra però in gioco un ulteriore fattore di complicazione, che è esposto nel dettaglio dell’appendice al termine di questo intervento: questa complicazione deriva dal fatto che ogni “molecola” di sale, una volta introdotta in acqua si scinde in più parti, ovvero in più ioni di carica opposta, incrementando in modo anche notevole (del doppio, del triplo o anche più) la concentrazione effettiva di specie chimiche in soluzione. Nel caso specifico del cloruro di sodio, questo risulta completamente dissociato in soluzione acquosa, ed ogni unità di sale introdotto ne origina semplicemente due complessive di ioni (Na+ e Cl-).
Ho fatto questa brevissima digressione per un motivo ben preciso: nella formula per calcolare l’abbassamento del punto di congelamento di un liquido, entra in gioco il peso formula del soluto, ovvero quanto è “grande” o “pesante” la sua molecola, o quanto sono pesanti gli atomi che la compongono. Ed entra in gioco in modo inversamente proporzionale, nel senso che più le molecole saranno piccole e leggere in termini di peso molecolare o peso formula, più il fattore “m” di molalità sarà elevato e quindi l’abbassamento crioscopico sarà marcato, a parità di grammi di soluto utilizzati. Infatti m = peso il grammi / peso formula.
Ma non solo. I soluti ionizzabili, i cosiddetti elettroliti forti, risultano essere decisamente più attivi, almeno il doppio, rispetto a quelli completamente indissociati in soluzione acquosa come ad esempio le molecole organiche covalenti come i glicoli o l’urea: questa ragione, oltre ovviamente all’economicità ed alla relativa innocuità di diversi dei suoi rappresentanti, favoriscono fortemente l’utilizzo di sali per abbassare la temperatura di congelamento dell’acqua sulle strade in inverno. Fra i vari sali, sarebbero in linea teorica favoriti quelli che dissociandosi originano un numero maggiore di ioni (il sodio cloruro NaCl genera 2 ioni: Na+ e Cl- ma il calcio cloruro, CaCl2 genera 3 ioni: Ca2+ e ben due Cl-), ma in pratica lo stesso fattore può anche ripercuotersi negativamente sul peso molecolare (peso-formula) della sostanza, incrementandolo, facendo sì in pratica che ogni chilogrammo di prodotto equivalga ad un numero inferiore di moli.
L’ideale sarebbe un sale a basso peso molecolare ma capace di scindersi completamente in cationi e anioni in soluzione, dando origine per ogni unità-formula introdotto ad un numero il più possibile elevato di ioni …se non fosse per ovvi problemi di costo e di tossicità si potrebbe pensare al fluoruro di alluminio AlF3!
Questa è fra le ragioni per le quali non avrebbe molto senso utilizzare come anticongelanti delle sostanze chimiche solubili in acqua ma a peso molecolare più alto del sale comune, ad esempio il comune zucchero (saccarosio), che con il suo peso molecolare di 342,296 uma conterrebbe nello stesso peso di prodotto secco solo un sesto all’incirca delle molecole che potrebbero essere contenute se la sostanza fosse stata cloruro di sodio, quindi solo 1/6 all’incirca della molalità di quest’ultimo, a parità di kg utilizzati.
Le sostanze chimiche utilizzata per provocare l’abbassamento del punto di congelamento dell’acqua, tanto negli impieghi stradali quanto in quelli nei circuiti di raffreddamento chiusi, come ad esempio quello del motore delle automobili e quelli industriali, sono di conseguenza molecole che potrebbero essere descritte dagli aggettivi “piccole” e “leggere”: lo stesso cloruro di sodio, che pesa soli 58,443 uma (unità di massa atomica), il glicole etilenico (62,068 uma), oggi largamente sostituito dal glicole propilenico, decisamente meno tossico del primo, (76,094 uma), l’urea (60,055 uma) e così via.
Qualcuno potrebbe a questo punto domandarsi la ragione per la quale al posto di salamoie, ovvero di soluzioni acquose, quindi liquide, di sodio cloruro, applicate con spruzzatori sul manto stradale si provveda nella stragrande maggioranza dei casi allo spargimento di un prodotto allo stato solido, granulare, che sembrerebbe a livello intuitivo non agire direttamente nella sua funzione antigelo, richiedendo una sua preliminare solubilizzazione nell’acqua circostante.
Per rispondere a questo questito in realtà bisognerebbe considerare almeno due fattori favorevoli all’uso di questo comune sale antighiaccio: il primo è che la presenza di materiali grossolani ed insolubili come sabbia o ghiaia fine aiuta di per sé ad incrementare l’aderenza degli pneumatici al fondo stradale, reso meno liscio dalla loro presenza; in secondo luogo, almeno quando il sale è sparso allo stato solido, di cristalli grossolani come da noi (e non sotto forma già di soluzione liquida concentrata come in altri Paesi del mondo), almeno localmente nei pochi centimetri quadrati intorno al punto dove cade, il sale viene a trovarsi allo stato solido, non immediatamente solubile nella pochissima acqua eventualmente ancora disponibile allo stato liquido.
Questo sale che viene a contatto come solido cristallino direttamente con il ghiaccio ed eventualmente con un poco di acqua liquida, ci trasporta però nel mondo del punto 2) citato in premessa, ovvero dell’altra tipologia di azione attribuibile al sale antighiaccio sparso sulle strade.
Questa azione riguardava “la promozione dello scioglimento del ghiaccio già formato, o anche della neve (depositata o di successivo deposito) che in fondo non è altro che ghiaccio finemente cristallizzato”. In questa situazione in seguito allo spargimento di sale viene a crearsi una situazione nella quale sono a contatto 3 materiali (detti più correttamente fasi) diverse: ghiaccio, sale allo stato solido ed una piccola acqua allo stato liquido.
Dopo pochissimo tempo una porzione (non tutto) il sale cristallino si sarà sciolto nella pochissima acqua liquida disponibile, venendo così a formare un sistema trifasico formato da: ghiaccio (ovvero acqua allo stato solido), sodio cloruro allo stato solido e soluzione acquosa satura di sodio cloruro. Descrivere esattamente e senza imperdonabili leggerezze cosa capita a questo punto è probabilmente impresa che supera le finalità di questo articolo.
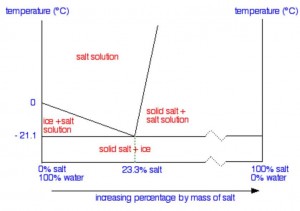
Possiamo dire semplicemente che ricadiamo in una circostanza nota in chimico-fisica come eutettico. In una miscela eutettica, composta in questo caso da solidi (sale e ghiaccio) e liquidi (acqua satura di sale) la temperatura di solidificazione complessiva è minore di quella che avrebbe ciascun componente preso separatamente; più specificamente esiste un rapporto fra i pesi dei diversi componenti (detto rapporto eutettico) nei quali questa temperatura è minima, ed è pertanto chiamata temperatura eutettica. Nel caso della miscela in questione la temperatura eutettica è addirittura di -21.3°C, a fronte di un rapporto eutettico che prevede però (in peso) ben il 23% di sodio cloruro contro il 77% di acqua, in parte ghiacciata ed in parte liquida.
In condizioni di equilibrio e ad una data pressione ambientale, i tre componenti dei quali abbiamo parlato (sodio cloruro solido, acqua solida cioè ghiaccio ed acqua liquida) possono coesistere solo nei rapporti di peso ed alla temperatura eutettici.
L’affermazione, che detta così potrebbe sembrare forse un po’ misteriosa, porta effettivamente a due conseguenze paradossalmente diverse, entrambe per certi versi sorprendenti:
A) Se aggiungiamo una quantità sufficiente di sale (finchè esso cessa di sciogliersi per soprassaturazione) ad una miscela di acqua e ghiaccio, la temperatura del sistema si abbasserà gradualmente da 0°C del solo ghiaccio a -21,3°C, corrispondenti alla temperatura dell’eutettico. Questo sistema può essere anche utilizzato in ambiente domestico quando non si disponesse di un congelatore potente ma solo di cubetti di ghiaccio e di sale, per provocare un veloce ed intenso raffreddamento, ad esempio di un’importante bottiglia di spumante che si vorrebbe rinfrescare davvero in pochi minuti!
B) Se il sale allo stato solido è aggiunto in eccesso al ghiaccio anche a pochi gradi sotto lo zero, eventualmente in presenza di una quantità anche estremamente piccola di acqua che ne consenta la formazione di una soluzione satura, ecco che gradualmente il ghiaccio tenderà a fondersi ed il cloruro di sodio a sciogliersi nell’acqua liquida via via formata. La temperatura complessivamente tenderà ad abbassarsi ulteriormente fino al teorico di -21,3°C, ma si assisterà alla disgregazione e quindi alla fusione di buona parte del ghiaccio, con la conseguenza di una auspicata liberazione del manto stradale dai tanto pericolosi lastroni.
STECHIOMETRIA DELL’ABBASSAMENTO CRIOSCOPICO
Vediamo ora come sia possibile effettuare dei semplici calcoli relativi all’abbassamento crioscopico di un liquido in relazione alla concentrazione di un soluto disciolto.
Riprendiamo la formula esposta precedentemente
abbassamento del punto crioscopico = costante crioscopica x concentrazione molale del soluto
L’unica nota da rimarcare per il non-chimico è che quando parliamo di concentrazioni in questo caso non stiamo parlando di percentuali o di grammi per litro, quindi nulla che si possa pesare “direttamente” con una bilancia, bensì di concentrazioni molali, ovvero di molalità della soluzione. Per chilogrammo e non per volume! Se ci fossimo riferiti al volume della soluzione avremo parlato di molaRità (con la “r”), mentre con la molaLità abbiamo a che fare con il peso del solvente. La concentrazione molale è il numero di moli che è sciolto per ogni chilogrammo di solvente. Se il liquido in questione, che funge da solvente, è acqua, parlare di peso o di volume è praticamente lo stesso dal momento che un litro di acqua a temperatura ambiente pesa esattamente un chilo. Ma dato che le proprietà colligative, compreso quindi l’abbassamento crioscopico, riguardano potenzialmente tutti i liquidi che possono fungere da solventi, ad esempio anche l’alcol etilico, gli oli, i solventi, i carburanti come il gasolio, ecc, ed avendo questi un peso per litro (detto anche densità) diverso da 1, diventa importante comprendere quale riferimento si debba considerare per effettuare la valutazione: il peso.
Nel caso di soluti ionici, come quelli di natura salina o comunque in parte o totalmente dissociati in soluzione, ogni mole di sostanza introdotta, dissociandosi totalmente o in parte in anioni e cationi di carica opposta, determina un numero di moli complessive in soluzione di fatto superiore rispetto a quello che sarebbe giustificabile dalla semplice introduzione di una sostanza solubile ma indissociabile, come ad esempio il glicole propilenico o altre molecole organiche covalenti. Nel caso del cloruro di sodio, che essendo un elettrolita forte risulta completamente dissociato in acqua, ogni mole di sale introdotto origina l’equivalente di una mole di ione sodio più una mole di ione cloruro in soluzione e quindi il valore di “m” che dovrebbe essere considerato nella formula soprastante per calcolare l’abbasamento crioscopico dev’essere moltiplicato per due.
Più in generale, possiamo calcolare il valore della molalità effettiva (m) moltiplicando il numero di moli di sostanza introdotta (m0) m con il cosiddetto coefficiente di Vant’Hoff:
m = m0 x [1+ a(v-1)]
dove “a” è il grado di dissociazione della molecola inizialmente introdotta (=1 se completamente dissociata, come il cloruro di sodio ed il cloruro di calcio, =0 per i soluti indissociati come il glicole propilenico, intermedio ad esempio per gli acidi carbossilici e gli altri elettroliti deboli).
“v” è invece il numero di ioni derivati dalla dissociazione di una singola molecola (o nel caso di una sostanza ionica da un’unità-formula) di elettrolita introdotta (es. v=2 per NaCl, v=3 per CaCl2, v=5 per Al2(SO4)3, ecc).
La costante crioscopica molale invece dipende esclusivamente dal liquido che stiamo esaminando e si esprime in °C*kg/mol. La costante crioscopica molale dell’acqua è 1,86.
Proviamo a considerare un esempio.
Se abbiamo a disposizione 4 litri di acqua e 70 g di sodio cloruro (sale comune), vediamo a che temperatura potrà congelare la soluzione ottenuta.
Innanzitutto dobbiamo calcolare la concentrazione molale del sale nella soluzione, detta anche molalità (m). Dato che l’acqua ha densità pari ad 1, 4 litri equivalgono a 4 kg, ovvero 4000 g. A dire il vero non saranno 4000 g esatti perché questa è solo la quota dell’acqua (il solvente): ad essa dobbiamo aggiungere i 70 g di peso dovuti al sale aggiunto (il soluto), ottenendo 4070 g di peso di acqua salata (la soluzione).
Il peso molecolare del cloruro di sodio è dato dalla somma dei pesi atomici di tutti gli elementi che compongono la specie chimica, moltiplicati per il numerino che compare in basso a destra di ciascuno di essi, il cosiddetto coefficiente stechiometrico. Per il sodio cloruro, in formula NaCl, il fatto che non compaia esplicitamente nessun numerino come pedice destro di ciascun simbolo atomico indica che il sale è composto da un solo atomo di sodio (Na) e da un solo atomo di cloro (Cl). Quindi sommando il peso atomico del sodio (22,98977) con il peso atomico del cloro (35,453) otteniamo un peso molecolare (pm) di 58,443
La formula per ricavare il numero delle moli contenute in un dato peso di sostanza chimica è
n° moli = peso in grammi / pm
ovvero in questo caso:
n° moli = 70 / 58,443 = 1,1977 moli
La formula per ricavare la concentrazione molale (m) è la seguente:
m = n° moli introdotte x [1+ a x(v-1)] = 1,1977 x 2 = 2,3954
molalità = numero moli / peso solvente
ovvero nel nostro caso:
molalità = 2,3954 / 4 = 0,59885 m
utilizzando la prima delle formule riportate è quindi possibile calcolare di quanto scenderà la temperatura di congelamento dell’acqua rispetto agli zero gradi celsius originali:
ΔT = costante crioscopica dell’acqua x molalità soluzione
ΔT = 1,86 °C/m x 0,59885 m = 1,11 °C
Ovvero l’acqua in questione congelerà a -1,11°C.
Se volessimo invece capovolgere il quesito, domandandoci per esempio quanto cloruro di sodio avremmo dovuto aggiungere agli stessi 4 litri di acqua per abbassare a -5°C la temperatura di congelamento (già un valido aiuto in caso di gelate non estreme), avremmo dovuto svolgere il seguente calcolo:
da questa formula:
ΔT = costante crioscopica dell’acqua x molalità soluzione
“tiriamo fuori” il valore della molalità richiesta, ovvero:
molalità soluzione = ΔT / costante crioscopica dell’acqua
molalità soluzione = 5 °C/m / 1,86 = 2,69 m
e da:
molalità = ( numero moli x [1+ a x(v-1)] ) / peso solvente
allo stesso modo “tiriamo fuori” matematicamente (anche se con una piccola approssimazione) il numero di moli richiesto:
numero moli = ( molalità x peso solvente ) / 2
n° moli = (2,69 x 4)/2 = 5,38 moli
Infine per ricavare il peso di sodio cloruro espresso in grammi, a partire da:
n° moli = peso in grammi / pm
otteniamo:
peso = n° moli x pm = 5,38 x 58,443 = 314 g
Quindi 314 g di sodio cloruro sono necessari per abbassare da 0°C a -5°C il punto di congelamento di 4 litri di acqua.
TABELLA DELLE COSTANTI CRIOSCOPICHE MOLALI (Kf in °C*kg/mol) E DEI PUNTI DI FUSIONE (p.f. in °C) PER ALCUNI SOLVENTI
Acetone / Kf 2.7 / p.f. 0.0°C
Acido acetico / Kf 3.9 / p.f. +16.7°C
Acqua / Kf 1.86 / p.f. -95°C
Anilina / Kf 5.9 / p.f. -6.2°C
Benzene / Kf 5.1 / p.f. +5.5°C
Carbonio disolfuro / Kf 3.8 / p.f. -108.5°C
Carbonio tetracloruro / Kf 32.0 / p.f. -22.6°C
Cicloesano / Kf 20.0 / p.f. +6.2°C
Cloroformio / 4 Kf.8 / p.f. -63.5°C
Fenolo / Kf 7.3 / p.f. +42.0°C
Nitrobenzene / Kf 7.0 / punto di fusione: +5.7°C
Metanolo / Kf 2.6 / p.f. -97.8°C