Indice
In questa guida spieghiamo quali approcci possono essere seguiti per concentrare una soluzione.
Ci ho pensato un po’ su, per cercare di enumerare brevemente le tecniche disponibili; poi mi è venuto in mente che non mi era stato detto di quale solvente si trattasse, e neppure se fosse liquido, gassoso o solido (ebbene sì, perché le soluzioni possono aversi in ciascuno stato della materia), ed infine quale fosse il soluto da concentrare. In altre parole se esso, considerato allo stato puro ed in condizioni di temperatura e pressione ambiente, fosse stato a sua volta un solido, un liquido o un aeriforme, ed infine in suo peso molecolare, il suo punto di ebollizione, la sua stabilità termica, la sua polarità, le sue proprietà elettrolitiche…
In pratica più ci pensavo, più mi accorgevo che da un lato le tecniche disponibili erano molte ed utilizzabili secondo molteplici accorgimenti, dall’altra che questa molteplicità diciamo così “nell’offerta” tecnologica era motivata semplicemente dal fatto che la domanda stessa era al suo interno drammaticamente diversificata.
La concentrazione di una soluzione, infatti, può essere ritenuta come un sotto-caso, a dire il vero uno dei più importanti, all’interno della cosiddetta Scienza delle Separazioni.
Un argomento questo oggetto di interi percorsi d’insegnamento universitari, in particolare nei corsi di laurea in chimica industriale ed in ingegneria chimica, di una moltitudine di pubblicazioni e di convegni periodici organizzati ormai in ogni nazione progredita.
Perché in fondo “concentrare” qualcosa, anche al di fuori della chimica, significa semplicemente accrescerne la separazione da qualcos’altro, non fosse altro dallo spazio vuoto: nel caso di una soluzione, concentrare significa agire in direzione di una separazione delle molecole del soluto da quelle del solvente.
Questa separazione è imprescindibilmente legata alla tipologia di molecole del soluto e del solvente, ovvero alla loro struttura che, come sappiamo, ne determina in modo conseguenziale le proprietà chimiche e, forse ancor più importanti, nell’ambito della scienza delle separazioni, di quelle fisiche.
Il concetto di concentrazione è anche correlato con quello, ad esso per certi versi complementare, di estrazione. L’estrazione comporta quasi per definizione l’impiego di un mezzo terzo, diverso dal soluto e dal solvente, in pratica un “agente estraente”. L’esito del processo è, come dice la parola stessa, un’estrazione, ovvero una rimozione del soluto dalla soluzione di partenza, con il suo trasferimento altrove, ad esempio in un altro tipo di solvente oppure su di un supporto solido, e questa estrazione può essere o non essere accompagnata da un incremento della concentrazione del soluto in questione rispetto al nuovo sistema del quale entra a far parte. Di fatto, come avremo modo di osservare nella seconda parte dell’articolo, quella per estrazione può di fatto essere intesa come una delle possibili tecniche di concentrazione.
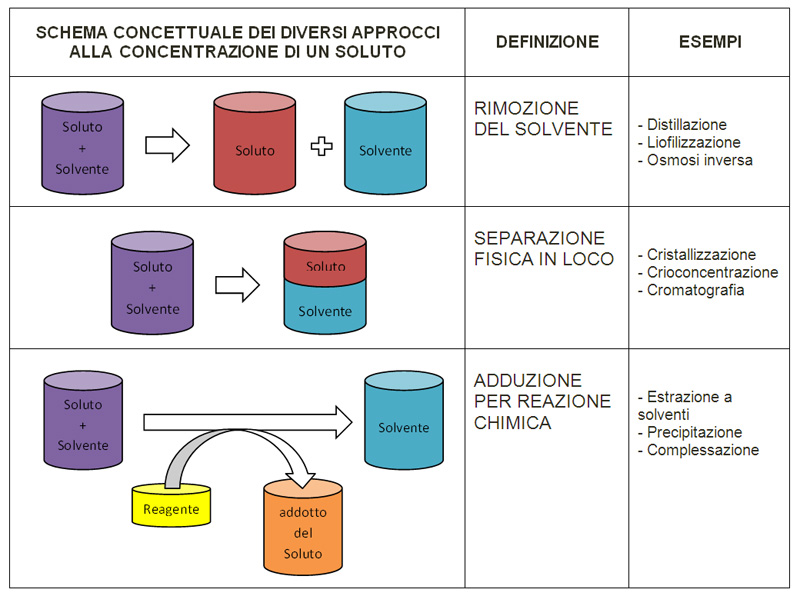
RIMOZIONE DEL SOLVENTE
Uno degli approcci più intuitivi ed utilizzati anche nella tradizione, diciamo “non scientifica”, è quello di rimuovere il solvente, totalmente o in parte, dal “sistema” rappresentato dalla soluzione.
Questa rimozione può essere a sua volta operata in diverso modo, a seconda delle caratteristiche del solvente, sempre considerate “per raffronto” con quelle del soluto da concentrare.
Rimozione del solvente in forma vapore
– L’evaporazione del solvente può avvenire previo riscaldamento, come nel caso di un distillatore, o anche di una soluzione lasciata al sole (es. l’acqua di mare nelle saline) quando la sua temperatura di ebollizione è nettamente inferiore a quella del soluto da recuperare, ed inoltre quest’ultimo non è soggetto a decomposizione, chimica o microbiologica, alla temperatura e nei tempi richiesti per il processo.
– L’evaporazione sotto vuoto è una particolare variante dell’evaporazione alla quale si ricorre quando la temperatura di ebollizione del solvente è criticamente alta, tanto da poter essere raggiunta con difficoltà nel contesto operativo corrente, o nel più dei casi tanto da mettere a rischio la preservazione dell’integrità molecolare del soluto. Con l’evaporazione sotto vuoto, realizzabile sotto forma di distillazione o di essiccazione, è possibile rimuovere il solvente ad una temperatura ben inferiore rispetto a quella che ne definisce il punto di ebollizione a pressione ambientale, tanto da rendere possibile l’ebollizione dell’acqua a 20°C, o addirittura dell’acqua allo stato solido, ovvero la sublimazione del ghiaccio, nella particolare variante di questo processo nota come Liofilizzazione.
Risulta essere tuttavia importante sottolineare che l’evaporazione del solvente, anche qualora condotta sotto vuoto a temperature ridotte, assorbe calore dall’esterno. Se ad esempio facciamo evaporare acqua da un pallone sotto vuoto a 20°C, dopo un certo tempo sentiremo che l’esterno del pallone si è raffreddato e nel contempo la velocità dell’evaporazione diminuisce: questo è un segno che il sistema sta assorbendo calore dall’esterno e per favorire il proseguimento del processo dovremo consentire il rifornimento di questo calore. Non abbiamo timore di scaldare eccessivamente l’esterno di questo pallone: se il grado di vuoto è sufficiente a far bollire il solvente a 20°C, se noi scaldiamo l’esterno (per esempio con un bagnomaria) non a 20°C ma a 40°C, semplicemente renderemo più veloce l’ebollizione e quindi la rimozione del solvente, mentre la temperatura al suo interno resterà comunque stabilizzata sui 20°C, che sono appunto dettati dal grado di vuoto, praticato per esempio tramite un’apposita pompa a valle.
Separazione su membrane
Negli ultimi decenni, ed in particolare con un’impennata a partire dagli anni ’90, sono state sviluppate tecnologie di separazione molecolare basate su fogli di membrane dotate di una porosità talmente ridotta da essere confrontabile con quelle della taglia delle molecole stesse da separare. Queste tecnologie si rivolgono primariamente al settore industriale, ma negli ultimi tempi i costi di produzione e di ingegnerizzazione degli impianti si sono ridotte in modo tale da consentirne l’impiego anche a livello domestico, per esempio nella depurazione delle acque per uso potabile. Lo stato fisico sul quale lavorano abitualmente è quello liquido, ma applicazioni di nicchia esistono anche verso gli stati aeriformi.
Sono un’evoluzione su scala molecolare delle tecniche di filtrazione, con però una importante differenza non solo di dimensione ma anche di concetto: mentre con la filtrazione si separano sistemi già di per sé stessi non omogenei (con particelle non in soluzione, bensì in sospensione o in dispersione, o addirittura sedimentate), con le filtrazioni a membrana la separazione è comunque effettuata su specie chimiche in soluzione, siano esse quelle rappresentate dal soluto oppure dal solvente.
Dal punto di vista della discriminazione tra quanto riesce a passare dalla membrana, essendo di diametro molecolare inferiore alla porosità, possiamo classificare le tecniche di filtrazione a membrana in microfiltrazione (porosità più grossolana, per lo più con funzione debatterizzante), ultrafiltrazione (rimozione di macromolecole in soluzione, come ad esempio proteine, polisaccaridi, tannini, coloranti), nanofiltrazione (rimozione di piccole molecole organiche, zuccheri semplici, ecc) ed infine osmosi inversa.
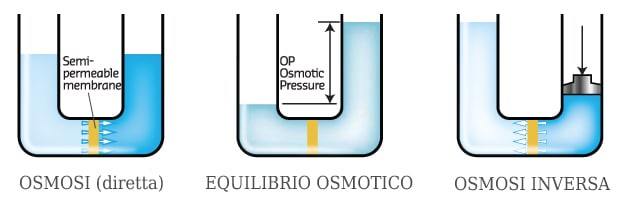
Quest’ultima è per l’appunto una delle tecniche di concentrazione di un soluto da soluzioni acquose diluite in assoluto più economica disponibile sul mercato a livello industriale, e lavora bene a temperatura ambiente su soluti di diversa natura: dagli elettroliti forti, completamente dissociati in acqua, come i sali, ma anche in molecole idrosolubili non ioniche, come ad esempio gli zuccheri, gli acidi organici ed un’infinità di altre molecole organiche ed inorganiche. In tutti questi casi le molecole del soluto sono quel tanto più grandi, almeno nella loro conformazione più stabile e ricorrente in soluzione acquosa, rispetto alla sezione della porosità della membrana, da essere trattenute, mentre quelle del solvente vi passano attraverso… a meno naturalmente di utilizzare un solvente con dimensioni molecolari maggiori rispetto a quelle del soluto.
Anche se il processo può apparire inaspettatamente semplice, sono necessarie alcune fondamentali attenzioni affinché esso proceda senza bloccarsi dopo la prima goccia di prodotto trattato. In primo luogo, queste membrane non possono essere usate alla maniera dei filtri tradizionali, ad esempio ponendoli sul fondo di un contenitore o di un imbuto, con la massa di liquido che preme perpendicolarmente su di esse, in quanto in queste condizioni andrebbero solitamente incontro ad un intasamento pressoché immediato. Al contrario, esse sono utilizzabili al meglio attraverso la tecnica che viene definita come “filtrazione tangenziale”, un processo che comporta il continuo scorrimento ad alta velocità del liquido (riciclato su sé stesso o in parte rinnovato) in un sottile strato sul foglio di membrana, al fine di rimuovere dalla sua superficie con il flusso ogni traccia di molecole più grandi della porosità della membrana. Un altro accorgimento indispensabile è quello di mantenere un sufficiente differenziale di pressione tra il lato della membrana a monte (quello a contatto con la soluzione da trattare) e quello a valle, dal quale usciranno le molecole più piccole, che nel loro insieme prenderanno il nome di permeato. Questa pressione serve in primo luogo a vincere quella che appunto è nota come “pressione osmotica”, rappresentando la naturale tendenza di un soluto a muoversi nella direzione del riequilibrio delle concentrazioni, quindi dalle zone a concentrazione maggiore verso quelle a concentrazione minore: un processo questo del quale, con l’esercizio di una pressione sufficiente in testa all’alimentazione, possiamo ottenere appunto l’inversione.
Spesso le tecniche di filtrazione a membrana, proprio ad iniziare dall’osmosi inversa, non sono utilizzate tanto per concentrare il soluto, quanto per ottenere il solvente in forma pura: è questo che capita negli impianti di purificazione dell’acqua tramite queste tecniche, compresi quelli per la sua demineralizzazione.
EPARAZIONE FISICA IN LOCO
Cristallizzazione
(per raffreddamento, per evaporazione parziale del solvente) Secondo questo approccio, il solvente non è materialmente rimosso dal sistema dove si trovava inizialmente: semplicemente se ne determina una separazione “in loco”, parziale o totale, rispetto al soluto. In linea di massima si ottiene un soluto puro (cristallino), accanto ad un solvente che ne contiene ancora una certa quantità al suo interno (soluzione satura). La cristallizzazione del soluto, per antonomasia recuperato allo stato solido, può essere operata a sua volta per: – raffreddamento della soluzione: per la maggior parte delle sostanze solubili in un certo sovente (anche se non tutte), il limite massimo di concentrazione oltre il quale cessano di solubilizzarsi – o vista dal punto di vista del solvente, la concentrazione massima della soluzione satura – è proporzionale alla temperatura. Raffreddando una soluzione è possibile far superare a questa il suo limite di saturazione, con la conseguente cristallizzazione del soluto in eccesso, in forma pura.
Questo procedimento è realizzabile anche con la variante denominata “crioconcentrazione” attraverso la quale si cristallizza non il soluto ma il solvente in forma pura, provocando di conseguenza una concentrazione del soluto della parte della soluzione che non è cristallizzata. E’ per questo che, ad esempio, l’acqua intorno agli iceberg risulta più salina di quella dalla quale non si sono formati brocchi di ghiaccio, ed il ghiaccio dell’iceberg in sé stesso non è salato. – evaporazione parziale del solvente: in pratica, partendo dall’approccio a pressione ambiente o sotto vuoto descritto nella sezione precedente, si sceglie di arrestare la rimozione del solvente prima che questa sia totalmente terminata. In queste condizioni, ripristinando la pressione e la temperatura di partenza nella soluzione, si osserva spesso una sua rapida cristallizzazione.
Anche se non è certamente possibile definirla come cristallizzazione, anche la separazione di un soluto liquido da un solvente anch’esso liquido è possibile senza abbandono da parte di quest’ultimo del sistema. Come nei casi precedenti, le tecniche verteranno nell’individuazione delle idonee condizioni di temperatura e di concentrazione della soluzione, tali da consentire il raggiungimento della cosiddetta “lacuna di solubilità” del soluto. E’ ad esempio da notare che molti liquidi sono miscibili fra loro solo in certi rapporti, ma non al di sopra oppure non al di sotto di altri, e questi limiti critici oltre i quali l’eccedenza di liquido si separa, galleggiando o sedimentandosi rispetto all’altro a seconda della densità relativa, è primariamente dettata dalla temperatura. Un esempio di questo comportamento è riscontrabile anche a livello domestico utilizzando alcol etilico ed un olio alimentare. Anche la solubilità di un gas in un solvente liquido può essere modificata in funzione sia della temperatura che della pressione. Solitamente scaldando una soluzione di un gas in un liquido (es. l’acqua frizzante) si ha una riduzione nella solubilità del gas, che si separa per tanto in forma pura sotto forma di bollicine.
– Affinità in media, con opzione differenziale
Si tratta di tutta quella moltitudine di processi, utilizzati tanto in campo industriale quanto in quello analitico, basati sulla differenze con cui il soluto ed il solvente interagiscono con una terza specie chimica, che può essere a sua volta solida, liquida o aeriforme, senza comunque che si realizzino con essa reazioni chimiche, o per lo meno non reazioni chimiche irreversibili. A differenza di quanto descritto nel terzo approccio alla concentrazione di un soluto (quello per “reazione chimica”), nel nostro caso alla fine del processo il soluto potrà essere recuperato sotto forma della stessa specie chimica che era presente inizialmente in soluzione, solo maggiormente concentrato.
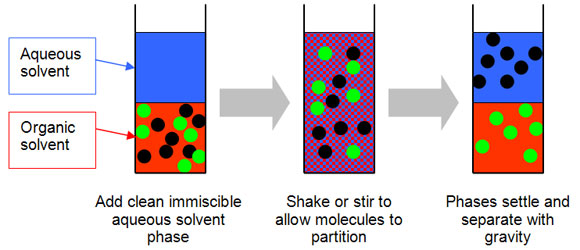
Anche se in apparenza potrebbe non sembrare così, si tratta comunque di tecniche di separazione “in loco” dal momento che le molecole di soluto, di una o di più specie chimiche eventualmente in miscela fra loro, seppur ripartite variamente tra fasi e tempi diversi, non lasciano nel loro insieme il “sistema” di riferimento dal quale si era inizialmente partiti, ma si muovono soltanto all’interno di esso. Tra le tecniche di maggiore e più variegato impiego in questo ambito si ricorda in particolare l’estrazione liquido/liquido, che prevede il mescolamento vigoroso di un secondo solvente, immiscibile con quello di partenza che contiene il soluto e più affine con il soluto stesso rispetto ad esso. Nel caso in cui non si disponga di un solvente più affine al soluto rispetto a quello di partenza è possibile allestire un’apparecchiatura tale da consentire numerosi cicli di estrazione liquido/liquido, evaporazione di parte del solvente dalla nuova soluzione, condensazione di una porzione del solvente “fresco” (privo del soluto al suo interno), e suo reimpiego per estrarre un’ulteriore aliquota del soluto, in una ciclica che può ripetersi anche decine o centinaia di volte, fino all’estrazione di una porzione sufficiente del soluto.
Questo approccio può consentire un certo grado di differenziazione tra più specie chimiche copresenti nella soluzione iniziale, sfruttando proprio la diversa loro affinità con il solvente impiegato o, nel peggiore dei casi, il ricorso ad estrazioni successive con solventi diversi. Una tecnica molto semplice è quella che fa ricorso a materiali assorbenti, come ad esempio carboni attivi, resine allo stato granulare ed in genere a materiali solidi, spesso porosi, in grado di trattenere sulla loro estesa superficie le molecole del soluto. La restituzione delle stesse in forma concentrata potrà avvenire per “lavaggio” di questi media solidi precedentemente caricati, tramite un solvente altamente affine in grado di solubilizzare molto bene queste sostanze, oppure in molti casi mediante il calore.
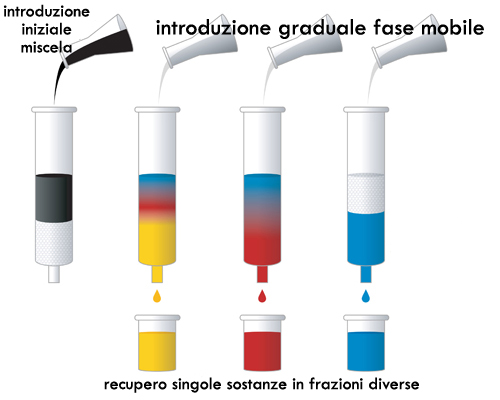
Un’ulteriore e più raffinata implementazione dell’approccio di affinità con un media è rappresentata da tutto il mondo delle cromatografie, da quelle più grossolane e preparative come la cromatografia flash a quelle industriali in continuo, fino a quelle destinate ad un impiego in chimica analitica, come quella liquida ad alta pressione e la gascromatografia.
Ciò che accomuna tutti gli approcci cromatografici è la condizione di far transitare la soluzione di partenza (liquida o gassosa) contenente il soluto (in questo caso detta fase mobile) attraverso o a contatto con un media solido o liquido (fase stazionaria) in grado di stabilire reversibilmente legami con il soluto, o meglio con le diverse specie chimiche che lo possono comporre, ed in primo luogo con il solvente stesso. L’approccio cromatografico nel più dei casi non è a considerarsi una tecnica di concentrazione diretta, nel senso che il soluto di nostro interesse potrà uscire non solo non più concentrato di com’era in partenza, ma addirittura più diluito, magari in un solvente composizionalmente diverso, ma come una tecnica d’eccellenza preliminare al recupero in forma purificata di uno o più componenti facenti parte del soluto in una soluzione complessa. Sulla base della diversa forza dei legami tra le diverse specie chimiche del soluto e la fase stazionaria si perverrà infatti ad una diversa temporizzazione nell’uscita dalla colonna cromatografica delle diverse sostanze, ciascuna è vero in soluzione diluita, ma in forma virtualmente isolata e su queste diverse porzioni di soluzione mono-componente potranno essere facilmente applicate le diverse tecniche di concentrazione finora illustrate.
REAZIONE CHIMICA
Si tratta dell’approccio probabilmente più “invasivo” nel sistema in soluzione. Esso consiste nel provocare una reazione a carico del soluto (più di rado del solvente) tale da trasformarlo in un prodotto più facilmente allontanabile dal solvente, purché una volta allontanato sia possibile invertire la reazione iniziale, restituendo quello che inizialmente era il soluto, in forma pura. Nella maggior parte dei casi, tuttavia, la reazione non sarà reversibile e l’esito del processo, più che quello di una concentrazione o di un’estrazione, si tradurrà nella sostituzione del secondo termine della coppia problematica “soluto+solvente” che diventerà per tanto “soluto+reagente”, o meglio ancora dal momento che il soluto stesso ha in qualche modo di fatto reagito” reagente1+reagente2”. Il prodotto di reazione tra i due reagenti, che è in fondo la specie chimica con la quale avremo a che fare, per dare un senso al procedimento dovrà essere facilmente separabile ed isolabile in forma pura, ad esempio per cristallizzazione o precipitazione (che è anch’essa una forma di micro-cristallizzazione), per distillazione, per estrazione in un solvente immiscibile e così via. Tecniche di questo genere solo utilizzate per esempio per il recupero di metalli preziosi (o, al contrario, tossici e quindi di interesse ambientale) a bassa concentrazione dalle acque, sotto forma di complessi solubili in solventi organici immiscibili con l’acqua.
Risulta essere possibile per esempio recuperare un pugno di organo-complesso ad altissimo tenore di metallo, tutto lo ione dello stesso metallo disperso in numerosi ettolitri di acqua di miniera. Come recuperare il metallo puro a partire dai suoi addotti sarà poi compito di altri specialisti, ovvero di altri settori della chimica, ma non possiamo comunque negare che l’oro, il mercurio o di quant’altro si fosse trattato, è stato in effetti ben concentrato rispetto alle condizioni iniziali. In pratica, per utilizzare un linguaggio decisamente colloquiale, si sarà trasformato un problema in un altro diverso. Ma per un chimico questo può già essere un grandissimo passo avanti.
Risulta essere possibile fare precipitare uno ione da una soluzione acquosa tramite l’accoppiamento con un controione di carica opposta con il quale formi un sale (ma anche un idrossido o un acido) poco solubile, per lo meno in quelle determinate condizioni di temperatura. L’aliquota di sale che supera la soglia di saturazione della soluzione inizierà ad intorbidirla e tenderà spontaneamente a sedimentarsi, con la possibilità di essere recuperato per filtrazione o per centrifugazione. Anche nell’estrazione mediante solventi immiscibili con quello di partenza è possibile sfruttare la reazione, in certi casi anche molto selettiva, tra il nostro soluto ed un reagente introdotto dall’esterno. In questo caso si punterà su di un prodotto di reazione il più possibile affine con il nuovo solvente introdotto, che fungerà in questo modo da agente estraente, e magari anche suscettibile ad un’inversione nel processo di reazione con il nostro soluto. E’ questo che capita per esempio quando si sfrutta la idrofobicità di addotto supramolecolari reversibili tra cationi inorganici e piccole molecole organiche ad effetto chelante, come ad esempio gli eteri corona o la 8-idrossichinolina, per la loro estrazione e concentrazione in una piccola aliquota di un solvente apolare a loro affine ed insolubile con l’acqua, come ad esempio il cloroformio. Anche la corrente elettrica può rappresentare una sorta di “reagente”, dal momento che gli elettroni da essa trasportati sono in grado di ridurre lo stato di ossidazione di alcuni elementi chimici che entrano in contatto con essi. Risulta essere il caso del recupero in forma pura di un metallo da una soluzione acquosa mediante elettrodeposizione in una cella galvanica, per riduzione sul catodo (l’elettrodo positivo, che emettendo elettroni attira e quindi riduce i cationi) dello ioni metallico, idrosolubile, in uno strato di metallo elementare, che potrà in seguito essere distaccato dall’elettrodo in vari modi, compresa la ridissoluzione in forma cationica a seguito di attacco con un altro acido.